题目内容
【题目】某化学小组用下列装置制取收集纯净的氯气,并研究其性质。请回答下列问题。

(1)装置甲中仪器A的名称是__,丙中应装的溶液是__,甲装置中发生反应的离子方程式为__。制取收集纯净氯气的装置接口连接顺序是a→…→g__(补充完整)。
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
①方案:采用酸碱中和滴定法测定。
②进行方案实验:准确量取残余清液稀释一定倍数后作为试样。
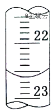
量取试样20.00mL于锥形瓶中,若锥形瓶中存有少量水,对实验结果是否有影响?__(填“是”或“无”)。用0.10molL-1NaOH标准溶液滴定,消耗NaOH标准溶液的体积如右图所示,其读数为__mL。
(3)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂___。
【答案】分液漏斗 饱和NaCl溶液 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O debcf 无 22.60
Mn2++Cl2↑+2H2O debcf 无 22.60 
【解析】
实验设计的目的是利用装置制取、收集纯净的氯气,并研究其性质。而在制得的Cl2中,混有浓盐酸挥发出的HCl气体和水蒸气,所以应先除去HCl,再干燥去除水蒸气,最后进行氯气的性质实验;因为氯气有毒,会污染环境,所以还应有尾气处理装置。
(1)装置甲中仪器A用于添加液体,并能控制液体的用量,其名称是分液漏斗,装置丙用于除去Cl2中的HCl,所以应装入的溶液是饱和NaCl溶液,甲装置用于制取Cl2,MnO2与浓盐酸反应生成MnCl2、Cl2和H2O,发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。制取、收集纯净氯气时,应先除去HCl,再干燥去除水蒸气,最后进行氯气的性质实验,由此得出装置接口连接顺序是a→debcf→g。答案为:分液漏斗;饱和NaCl溶液;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O。制取、收集纯净氯气时,应先除去HCl,再干燥去除水蒸气,最后进行氯气的性质实验,由此得出装置接口连接顺序是a→debcf→g。答案为:分液漏斗;饱和NaCl溶液;MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;debcf;
Mn2++Cl2↑+2H2O;debcf;
(2)量取试样20.00mL于锥形瓶中,若锥形瓶中存有少量水,由于样品的物质的量不变,所以对实验结果无影响。用0.10molL-1NaOH标准溶液滴定,消耗NaOH标准溶液的体积为22.60mL。答案为:无;22.60。
(3)上述方案缺少尾气吸收装置,应使用NaOH溶液吸收,且导管口插入液面下。该装置图为 。答案为:
。答案为: 。
。

【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
请回答下列问题:
(1)H2CO3的第二级电离平衡常数的表达式K2=______。
(2)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为____。
(3) 用足量Na2CO3溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为____。
(4)25℃时,向0.1 molL-1的氨水中缓缓少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是______。
A. B.
B.
C.  D.
D.
(5)能证明醋酸是弱酸的实验事实是______(填写序号)。
① 相同条件下,浓度均为0.1 molL-1的盐酸和醋酸,醋酸的导电能力更弱
② 25℃时,一定浓度的CH3COOH、CH3COONa混合溶液的pH等于7
③ CH3COOH溶液能与NaHCO3反应生成CO2
④ 0.1molL-1 CH3COOH溶液可使紫色石蕊试液变红
(6)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示。

① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是______。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)




