题目内容
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
请回答下列问题:
(1)H2CO3的第二级电离平衡常数的表达式K2=______。
(2)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为____。
(3) 用足量Na2CO3溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为____。
(4)25℃时,向0.1 molL-1的氨水中缓缓少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是______。
A. B.
B.
C.  D.
D.
(5)能证明醋酸是弱酸的实验事实是______(填写序号)。
① 相同条件下,浓度均为0.1 molL-1的盐酸和醋酸,醋酸的导电能力更弱
② 25℃时,一定浓度的CH3COOH、CH3COONa混合溶液的pH等于7
③ CH3COOH溶液能与NaHCO3反应生成CO2
④ 0.1molL-1 CH3COOH溶液可使紫色石蕊试液变红
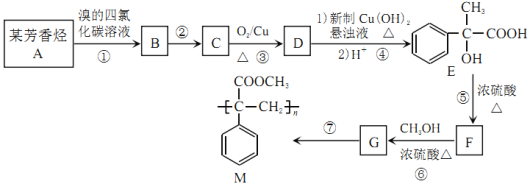
(6)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示。

① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是______。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
【答案】![]() c(CH3COONa)>c(Na2SO3)>c(Na2CO3) 2CO32-·+H2O+SO2=2HCO3-+SO32- AC ①② c>b>a >
c(CH3COONa)>c(Na2SO3)>c(Na2CO3) 2CO32-·+H2O+SO2=2HCO3-+SO32- AC ①② c>b>a >
【解析】
(1). ![]() (2). c(CH3COONa)>c(Na2SO3)>c(Na2CO3) (3). 2CO32-·+H2O+SO2=2HCO3-+SO32- (4). AC (5). ①② (6). c>b>a (7).
(2). c(CH3COONa)>c(Na2SO3)>c(Na2CO3) (3). 2CO32-·+H2O+SO2=2HCO3-+SO32- (4). AC (5). ①② (6). c>b>a (7).

【题目】某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。(忽略氧气对反应的影响)
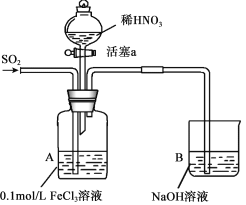
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向A装置中通入一段时间的SO2气体。 | A中黄色溶液迅速变成深红棕色,最终变为浅绿色。 |
II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液。 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀。 |
III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a。 | A中浅绿色溶液最终变为黄色。 |
IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气。 | 溶液变为红色;液面上方有少量红棕色气体生成。 |
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):________。
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为: Fe3+ + 6SO2 ![]() Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因________。
Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因________。
(3)实验II中发生反应的离子方程式是__________________。
(4)实验III中,浅绿色溶液变为黄色的原因是__________________(用离子方程式表示)。
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的化学方程式是______________。
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-。请从微粒变化的角度解释________。