题目内容
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
Ⅰ.已知:①2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0 kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180.5 kJ·mol-1
③2NO(g)+O2(g)=2NO2(g) ΔH3=-116.5 kJ·mol-1
(1)CO的燃烧热为______________。
(2)若1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g)分子中化学键断裂时需吸收的能量为________。
Ⅱ.利用水煤气合成二甲醚的总反应为:
3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ·mol-1
(3)它可以分为两步,反应分别如下:
①2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH1=-205.1 kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=________。
(4)已知CH3OCH3(g)的燃烧热为1455 kJ·mol-1,写出表示其燃烧热的热化学方程式:_________________________________。若二甲醚燃烧生成的CO2恰好能被100 mL 0.2 mol·L-1 NaOH溶液吸收生成Na2CO3,则燃烧过程中放出的热量为________。
【答案】283.0 kJ·mol-1 631.75 kJ -41.3 kJ·mol-1 CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH1=-1455 kJ·mol-1 7.275 kJ
【解析】
Ⅰ. (1)由①2CO(g)+O2(g) =2CO2(g) ΔH=-566.0kJ·mol1可知,2mol CO完全燃烧放出566.0kJ的热量,所以1mol CO完全燃烧放出283kJ的热量,所以CO的燃烧热为283kJ·mol1;
(2)若1mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,设1mol NO(g) 分子中化学键断裂时需吸收的能量为x kJ,由②N2(g)+O2(g)= 2NO(g) ΔH=946kJ·mol-1+498 kJ·mol-1 -2x kJ·mol-1=+180.5 kJ·mol-1,解之得x=631.75,所以1mol NO(g)分子中化学键断裂时需吸收的能量为631.75 kJ;
Ⅱ.(3)①已知:Ⅰ.3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g);△H=-246.4kJmol-1
Ⅱ.4H2(g)+2CO(g)═CH3OCH3(g)+H2O(g),△H1=-205.1kJmol-1
根据盖斯定律,Ⅰ-Ⅱ可得:CO(g)+H2O(g)═CO2(g)+H2(g),则△H2=△H-△H1=-246.4kJmol-1-(-205.1kJmol-1)=-41.3kJmol-1;
(4)已知CH3OCH3(g)的燃烧热为1455 kJ·mol-1,则表示其燃烧热的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH1=-1455 kJ·mol-1;100 mL 0.2 mol·L-1 NaOH溶液中含氢氧化钠0.02mol,若二甲醚燃烧生成的CO2恰好能被100 mL 0.2 mol·L-1 NaOH溶液吸收生成Na2CO3,消耗二氧化碳0.01mol,则燃烧过程中放出的热量为1455 kJ/mol![]() 0.005mol=7.275 kJ。
0.005mol=7.275 kJ。

【题目】某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。(忽略氧气对反应的影响)
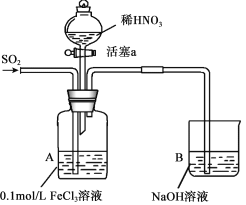
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向A装置中通入一段时间的SO2气体。 | A中黄色溶液迅速变成深红棕色,最终变为浅绿色。 |
II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液。 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀。 |
III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a。 | A中浅绿色溶液最终变为黄色。 |
IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气。 | 溶液变为红色;液面上方有少量红棕色气体生成。 |
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):________。
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为: Fe3+ + 6SO2 ![]() Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因________。
Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因________。
(3)实验II中发生反应的离子方程式是__________________。
(4)实验III中,浅绿色溶液变为黄色的原因是__________________(用离子方程式表示)。
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的化学方程式是______________。
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-。请从微粒变化的角度解释________。