题目内容
【题目】X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置___。
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是___(填元素符号)。
(3)元素的非金属性Z___Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有___ (填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
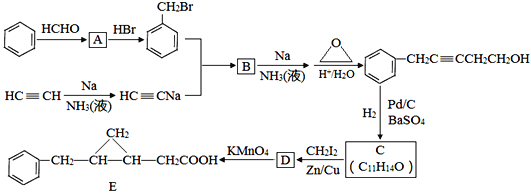
(4)若使A按下列途径完全转化为F,F的化学式为___。
![]()
【答案】第三周期ⅥA族 N > C HNO3
【解析】
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,则Z为氧(O);J元素的焰色反应呈黄色,则J为钠(Na);Q的最外层电子数与其电子总数比为3:8,则其为硫(S);X能与J形成离子化合物,且J+的半径大于X-半径,则X为氢(H);Y的氧化物是形成酸雨的主要物质之一,则Y为氮(N)。
由以上分析可知,X、Y、Z、J、Q分别为H、N、O、Na、S。
(1)Q元素为硫,电子排布式为1s22s22p63s23p4,所以其在周期表中的位置为第三周期ⅥA族。答案为:第三周期ⅥA族;
(2)同一周期,从左到右,原子半径减小,同一主族,从上到下,原子半径增大;这五种元素原子半径从大到小的排列顺序为Na>S>N>O>H,排在第三的元素原子是N。答案为:N;
(3)同一主族从上到下,元素的非金属性减弱;Z和Q分别为氧和硫,属于同一族元素,元素的非金属性Z>Q;
A.Q的氢化物的水溶液为氢硫酸,放置在空气中会被氧气氧化为硫,使溶液变浑浊,从而说明非金属性O>S,A不合题意;
B.Z与Q之间形成的化合物中,Z显负价,Q显正价,从而说明非金属性O>S,B不合题意;
C.Z和Q的单质分别呈气态和固态,属于物理性质,不能由状态推断非金属性,C符合题意;
D.Z和Q为同主族元素,Z在Q的上方,表明非金属性Z>Q,D不合题意;
故选C。答案为:>;C;
(4)由转化图可知,A中所含元素具有可变化合价,此元素为非金属元素,则D应为O2,C为非金属氧化物,C与H2O反应生成F和另一氧化物E,符合此条件的物质只有NO2,所以F为HNO3。答案为:HNO3。

 阅读快车系列答案
阅读快车系列答案【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
【题目】某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。(忽略氧气对反应的影响)
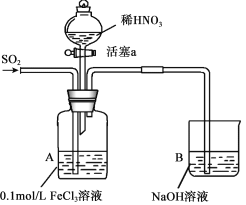
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向A装置中通入一段时间的SO2气体。 | A中黄色溶液迅速变成深红棕色,最终变为浅绿色。 |
II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液。 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀。 |
III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a。 | A中浅绿色溶液最终变为黄色。 |
IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气。 | 溶液变为红色;液面上方有少量红棕色气体生成。 |
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):________。
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为: Fe3+ + 6SO2 ![]() Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因________。
Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因________。
(3)实验II中发生反应的离子方程式是__________________。
(4)实验III中,浅绿色溶液变为黄色的原因是__________________(用离子方程式表示)。
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的化学方程式是______________。
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-。请从微粒变化的角度解释________。