题目内容
7.将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是( )| A. | 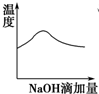 | B. | 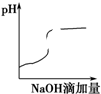 | C. |  | D. | 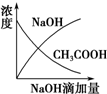 |
分析 A.酸碱中和反应是放热反应,但醋酸的电离是吸热反应;
B.醋酸是弱酸,常温下溶液的pH较小,和NaOH发生中和反应生成盐,pH升高,当氢氧化钠过量时溶液呈碱性;
C.溶液导电能力与离子浓度成正比;
D.NaOH不足量时,NaOH的物质的量是0;醋酸钠能水解生成醋酸,所以醋酸浓度不能是0.
解答 解:A.氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低,故A正确;
B.醋酸中滴加氢氧化钠酸性减弱pH增大,当酸碱恰好发生中和时,pH突变,醋酸完全反应后,溶液碱性逐渐增强,故B正确;
C.醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加,故C正确;
D.醋酸中滴加氢氧化钠,氢氧化钠和醋酸发生反应了,当醋酸剩余时,氢氧化钠物质的量0,醋酸中滴加氢氧化钠,即便醋酸完全反应,醋酸钠还是有微弱的水解,醋酸的浓度不可能为0,故D错误.
故选:D.
点评 本题考查酸碱混合溶液定性判断,侧重考查学生分析判断能力,注意B中pH变化的跳跃及D中浓度图象,含有能水解的盐溶液中一定含有弱电解质(水除外),注意:溶液导电能力与离子浓度有关,易错选项是BD.

练习册系列答案
相关题目
17.下列符号中,表示两个氢原子的是( )
| A. | H2 | B. | 2H2 | C. | $\stackrel{+1}{H}$ | D. | 2H |
15.将pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液的H+ 浓度最接近于( )
| A. | $\frac{1}{2}$(10-8+10-10)mol•L-1 | B. | (10-8+10-10)mol•L-1 | ||
| C. | (1×10-14-5×10-5)mol•L-1 | D. | 2×10-10mo1•L-1 |
2.下列电离方程式错误的是( )
| A. | NH3•H2O?NH4++OH- | B. | H2SO3?2H++SO32- | ||
| C. | Fe(OH)3?Fe3++3OH- | D. | H2SO4→2H++SO42- |
12.下列说法正确的是( )
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | NO2与水反应氧化剂与还原剂物质的量比为2:1 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 铁露置在空气中一段时间后会生锈;性质更活泼的铝不能稳定存在于空气中 |
19.下列物质的电子式书写正确的是( )
| A. | 氯化钠Na${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| B. | 氮气 | |
| C. | 氯化氢H${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| D. | 二氧化碳${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$C${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
16.要使有机物HO COOH转化为HO
COOH转化为HO COONa,可选用的试剂是( )
COONa,可选用的试剂是( )
 COOH转化为HO
COOH转化为HO COONa,可选用的试剂是( )
COONa,可选用的试剂是( )| A. | Na | B. | Na2CO3 | C. | NaHCO3 | D. | NaOH |
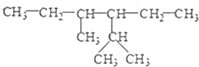 的系统命名为:2,4-二甲基-3-乙基乙烷
的系统命名为:2,4-二甲基-3-乙基乙烷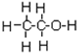 ,乙烯的电子式为
,乙烯的电子式为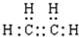
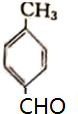 <
<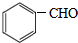
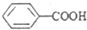 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性)
 .
.