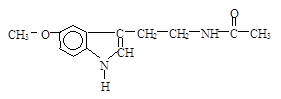
题目内容
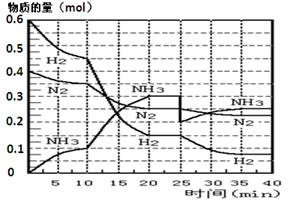
(17分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
回答下列问题:
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
(3)第1次平衡的时间范围为: ,第2次平衡的时间范围为: ,
第1次平衡:平衡常数K1 = (带数据的表达式),第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:
①曲线发生变化的原因:
②达第二次平衡时,新平衡的平衡常数K2 K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) 2NH3(g) +
2NH3(g) +  O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
回答下列问题:
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加NH3物质的量 |
第1次平衡:平衡常数K1 = (带数据的表达式),第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:
①曲线发生变化的原因:
②达第二次平衡时,新平衡的平衡常数K2 K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1)
 2NH3(g) +
2NH3(g) +  O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知:N2(g) + 3H2(g)
 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—12H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
(17分)(1)v = 0.005 mol·L-1 ·min-1 ;(1分) (2)AB(1分)
(3)20~25 min (1分) 35~40 min (1分)
K =(0.15)2 0.125×(0.075)3 (带数据的表达式),(1分) 45.5 % ;(1分)
(4)①移走0.1 mol NH3,(2分)②等于(1分)
(5)△H= —2.31 KJ·mol-1。(2分) (6) ①>、> (各1分)
②2N2(g) + 6H2O(1) = 4NH3(g) + 3O2(g) ΔH="+1530" kJ·mol-1 (2分)或
N2(g) + 3H2O(1) = 2NH3(g) +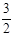 O2(g) ΔH="+765" kJ·mol-1 (2分)
O2(g) ΔH="+765" kJ·mol-1 (2分)
(3)20~25 min (1分) 35~40 min (1分)
K =(0.15)2 0.125×(0.075)3 (带数据的表达式),(1分) 45.5 % ;(1分)
(4)①移走0.1 mol NH3,(2分)②等于(1分)
(5)△H= —2.31 KJ·mol-1。(2分) (6) ①>、> (各1分)
②2N2(g) + 6H2O(1) = 4NH3(g) + 3O2(g) ΔH="+1530" kJ·mol-1 (2分)或
N2(g) + 3H2O(1) = 2NH3(g) +
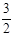 O2(g) ΔH="+765" kJ·mol-1 (2分)
O2(g) ΔH="+765" kJ·mol-1 (2分)(1)根据图像可知,10min时氨气的物质的量是0.1mol,浓度是0.05mol/L,所以其反应速率是0.05mol/L÷10min= 0.005 mol·L-1 ·min-1。
(2)根据图像可知,在10 ~20 min内氨气的生成速率增大,再20min时反应达到平衡状态,所以改变的条件应该是使用了催化剂会缩小了容器容积,答案选AB。
(3)反应进行到25min是物质的浓度又方式变化,所以第1次平衡的时间范围为20~25 min;同样根据图像可知,第2次平衡的时间范围为35~40 min;第1次平衡时氨气、氮气和氢气的浓度分别是(mol/L)0.15、0.125和0.075,所以K =(0.15)2 0.125×(0.075)3;第2次平衡时氨气、氮气和氢气的物质的量分别是(mol)0.25、0.225、0.075,所以氨气的体积分数是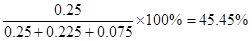 。
。
(4)①根据图像可知,25min是氨气的物质的量降低到0.2mol,而氮气和氢气的物质的量逐渐减小,所以改变的条件是移走0.1 mol NH3。
②温度不变,所以平衡常数是不变的。
(5)感觉图像可知,在25~40 min时,又生成0.05mol氨气,所以放出的热量是0.05mol×92.4kJ/mol÷2=2.31kJ。
(6)①根据表中数据可知,随着温度的升高,氨气的物质的量逐渐增加,说明升高温度,平衡向正反应方向移动,因此正反应是吸热反应;根据方程式可知,气体的分子数增加,所以熵值是增加的。
②根据盖斯定律可知,该反应的热化学方程式是2N2(g) + 6H2O(1) = 4NH3(g) + 3O2(g),所以反应热△H=-92 .4kJ·mol—1×2+3×571.6kJ·mol—1=+1530 kJ·mol-1。
(2)根据图像可知,在10 ~20 min内氨气的生成速率增大,再20min时反应达到平衡状态,所以改变的条件应该是使用了催化剂会缩小了容器容积,答案选AB。
(3)反应进行到25min是物质的浓度又方式变化,所以第1次平衡的时间范围为20~25 min;同样根据图像可知,第2次平衡的时间范围为35~40 min;第1次平衡时氨气、氮气和氢气的浓度分别是(mol/L)0.15、0.125和0.075,所以K =(0.15)2 0.125×(0.075)3;第2次平衡时氨气、氮气和氢气的物质的量分别是(mol)0.25、0.225、0.075,所以氨气的体积分数是
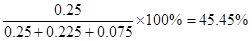 。
。(4)①根据图像可知,25min是氨气的物质的量降低到0.2mol,而氮气和氢气的物质的量逐渐减小,所以改变的条件是移走0.1 mol NH3。
②温度不变,所以平衡常数是不变的。
(5)感觉图像可知,在25~40 min时,又生成0.05mol氨气,所以放出的热量是0.05mol×92.4kJ/mol÷2=2.31kJ。
(6)①根据表中数据可知,随着温度的升高,氨气的物质的量逐渐增加,说明升高温度,平衡向正反应方向移动,因此正反应是吸热反应;根据方程式可知,气体的分子数增加,所以熵值是增加的。
②根据盖斯定律可知,该反应的热化学方程式是2N2(g) + 6H2O(1) = 4NH3(g) + 3O2(g),所以反应热△H=-92 .4kJ·mol—1×2+3×571.6kJ·mol—1=+1530 kJ·mol-1。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)在一定条件下达到平衡后,改变下列条件,请回答: N2O4(g),在体积都为V的A和B两个密闭玻璃容器中,分别注入容积颜色相同的NO2和Br2(气),然后将两个容器体积同时扩大为2V,过一会儿可以看到
N2O4(g),在体积都为V的A和B两个密闭玻璃容器中,分别注入容积颜色相同的NO2和Br2(气),然后将两个容器体积同时扩大为2V,过一会儿可以看到 3C(g)+2D(g) ,起始时四个容器内所装A、B的量如下:
3C(g)+2D(g) ,起始时四个容器内所装A、B的量如下: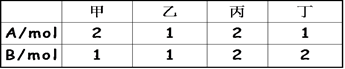
 C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为 SiF4 (g) + 2H2O(g),若该反应在恒温恒容的密闭容器中发生,不能判断反应已经达到化学平衡的是( )
SiF4 (g) + 2H2O(g),若该反应在恒温恒容的密闭容器中发生,不能判断反应已经达到化学平衡的是( ) 2NO2(g) ΔH=+52.70 kJ·mol—1。
2NO2(g) ΔH=+52.70 kJ·mol—1。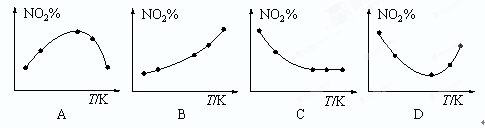
 2NO2在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是
2NO2在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是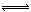 2NH3的平衡体系中,保持容器的体积和温度不变,充入氩气以增大压强,此时下列叙述正确的是
2NH3的平衡体系中,保持容器的体积和温度不变,充入氩气以增大压强,此时下列叙述正确的是