题目内容
相同容积的四个密闭容器中,进行同样的可逆反应2A (g) +B(g)  3C(g)+2D(g) ,起始时四个容器内所装A、B的量如下:
3C(g)+2D(g) ,起始时四个容器内所装A、B的量如下:
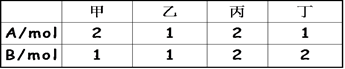
在相同温度下建立平衡时,A或B的转化率α的大小关系为( )
A、A的转化率:甲<丙<乙<丁 B、A的转化率:甲<乙<丙<丁
C、B的转化率:甲>乙>丙>丁 D、B的转化率:丁>乙>丙>甲
 3C(g)+2D(g) ,起始时四个容器内所装A、B的量如下:
3C(g)+2D(g) ,起始时四个容器内所装A、B的量如下: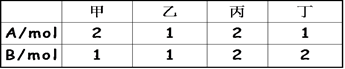
在相同温度下建立平衡时,A或B的转化率α的大小关系为( )
A、A的转化率:甲<丙<乙<丁 B、A的转化率:甲<乙<丙<丁
C、B的转化率:甲>乙>丙>丁 D、B的转化率:丁>乙>丙>甲
AC
此题考查的知识点是反应物的数值对转化率大小的影响。我们可以以乙、丙为基准,先比较它们两组A、B转化率的大小,再与甲、乙两组比较.丙组的A、B都为乙组的两倍,两容器的容积相同,所以丙容器的压强比乙容器的压强大,此反应正方向为气体体积增大的反应,压强大则化学平衡向逆反应方向移动,所以丙组的A、B的转化率都比乙组的小。
将甲组和乙组相比,B相同,A物质甲组比乙组多1mol,可看作甲组为在乙组的基础上增加了1molA,我们知道:增加A物质的量,其他反应物如B的转化率增大,A本身的转化率减小.所以A的转化率甲<乙,B的转化率甲>乙。
同理,丙组与甲组相比,A相同,B物质丙组比甲组多1mol,所以A的转化率甲<丙,B的转化率甲>丙。乙组与丁组相比,A相同,B物质丁组比乙组要多1mol,所以A的转化率乙<丁,B的转化率乙>丁。丙组与丁组相比,B相同,A物质丙组比丁组多1mol,所以A的转化率丙<丁,B的转化率丙>丁。
通过以上比较可得出结论:A的转化率甲<丙<乙<丁;B的转化率甲>乙>丙>丁所以正确的答
案选AC。
将甲组和乙组相比,B相同,A物质甲组比乙组多1mol,可看作甲组为在乙组的基础上增加了1molA,我们知道:增加A物质的量,其他反应物如B的转化率增大,A本身的转化率减小.所以A的转化率甲<乙,B的转化率甲>乙。
同理,丙组与甲组相比,A相同,B物质丙组比甲组多1mol,所以A的转化率甲<丙,B的转化率甲>丙。乙组与丁组相比,A相同,B物质丁组比乙组要多1mol,所以A的转化率乙<丁,B的转化率乙>丁。丙组与丁组相比,B相同,A物质丙组比丁组多1mol,所以A的转化率丙<丁,B的转化率丙>丁。
通过以上比较可得出结论:A的转化率甲<丙<乙<丁;B的转化率甲>乙>丙>丁所以正确的答
案选AC。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目
 2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。 2NO2,反应达到平衡的标志是
2NO2,反应达到平衡的标志是 H2(g)+I2(g),H2物质的量随时间的变化如图所示。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。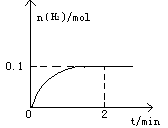
 Fe(s)+CO2(g) △H="a" kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是
Fe(s)+CO2(g) △H="a" kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是 ?pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )
?pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )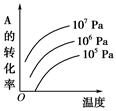
 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。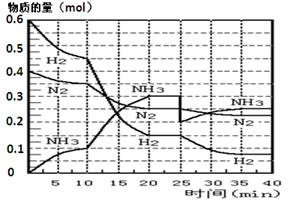
 2NH3(g) +
2NH3(g) + 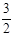 O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1
 2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是