��Ŀ����
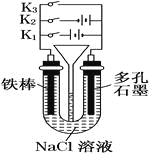
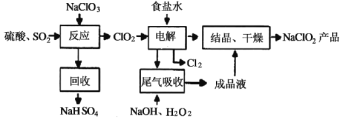
����Ŀ��֪ʶ��������������Чѧϰ�ķ���֮һ��ɽ���и߶���ѧ��ȤС�齫�й�����ⱥ��ʳ��ˮ����������ݽ����������γ��������⣨���е缫��Ϊʯī����������õ��Ȼ�����Һ�辫�ƣ���ȥ��Ӱ���Ca2+��Mg2+��NH4+��SO42������ɳ���侫���������£�
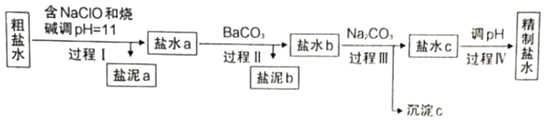
��֪����Ca2+��Mg2+��ʼ�γ���Ӧ�������������pH�����
Ca��OH��2 | Mg��OH��2 | |
pH | ��11.5 | ��9.2 |
��Ksp��BaSO4����1.1��10��10��Ksp��BaCO3����2.6��10��9��Ksp��CaCO3����5.0��10��9
��1������a����ɳ�⣬������___________���ѧʽ����
��2������I�У�NaClO�������ǽ�NH4+ת��ΪN2����Ӧ�����ӷ���ʽΪ________________��
��3�����̢��У�����c��Ҫ�ɷֵĻ�ѧʽΪ_____��
��4�����̢���pHĿ���dz�ȥ___________�������ӷ��ţ�
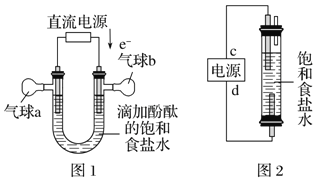
��5������ͼ1װ�õ�⾫���Ȼ���һ��ʱ�������b�е�������_____���ѧʽ��
��6������ͼ2����һ�ֻ���������Һ�������������Ʊ���84������Һ����Ч�ɷ�NaClO����cΪ��Դ��_____�����÷������з�Ӧ�������ӷ���ʽΪ_______________��
��7���������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ������������ͼ��Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��ա�
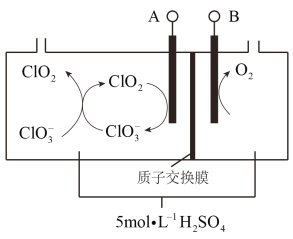
�����������ķ�Ӧ�У�_______________��__________________________��
�ڵ�����������״����112 mL����ʱ��ͨ�������ӽ���Ĥ���ӵ����ʵ���Ϊ_____��
���𰸡�Mg��OH��2 3ClO��+2OH��+2NH4+�T3Cl��+N2��+5H2O CaCO3 ��ȥ��Һ������OH����CO32�� H2 �� Cl��+H2O![]() ClO��+H2��
ClO��+H2�� ![]()
![]() 0.02
0.02
��������
����ˮ��NH4+�����������ӷ�Ӧ����笠����ӣ�����pH����þ���ӣ����˺����Һ����̼�ᱵ������������ܽ�ƽ��ת��Ϊ�����ܵ����ᱵ�����˺����Һ����̼���Ƴ��������ӣ����˺���Һ�����������pHֵ������Һ��̼��������������ӡ�
������a����ɳ�⣬����Ca2+��Mg2+��ʼ�γ���Ӧ�������������pH���õ�������Mg(OH)2���ʴ�Ϊ��Mg(OH)2��
�ƹ���I�У�NaClO��NH4+��Ӧ����N2��NaCl��H2O����Ӧ�����ӷ���ʽΪ3ClO��+2OH�� + 2NH4+ �� 3Cl�� + N2�� + 5H2O���ʴ�Ϊ��3ClO��+2OH�� + 2NH4+ �� 3Cl�� + N2�� + 5H2O��
�ǹ������У���Ҫ������̼���ƺ����ӷ�Ӧ����̼��ƣ���˳���c��Ҫ�ɷֵĻ�ѧʽΪCaCO3���ʴ�Ϊ��CaCO3��
�ȹ���I�е�pHֵ���������м����̼���ƹ�������˹�������pHĿ���dz�ȥ��Һ������OH����CO32���ʴ�Ϊ����ȥ��Һ������OH����CO32��
������ͼ1װ�õ�⾫���Ȼ���һ��ʱ����ݵ�����������õ��ұ�Ϊ���ص���������������ӵõ�������������������b�е�������H2���ʴ�Ϊ��H2��
������ͼ2����һ�ֻ���������Һ�������������Ʊ���84������Һ����Ч�ɷ�NaClO����˵�����������������Ʒ�Ӧ�����������Һ��������ַ�Ӧԭ�������·�Ӧ�õ��õ��������Ϸ��õ��������ƣ����cΪ�������÷������з�Ӧ�������ӷ���ʽΪCl�� + H2O ![]() ClO�� + H2�����ʴ�Ϊ������Cl�� + H2O
ClO�� + H2�����ʴ�Ϊ������Cl�� + H2O ![]() ClO�� + H2����
ClO�� + H2����
��������ͼ����Ϣ���Ҳ�õ���������ΪOH��ʧȥ��������������Ϊ���������Ϊ�����������õ����ӣ����ϼ۽��ͣ����ClO3���õ����ӱ�ΪClO2�����ɵ�ClO2��������������ԭ��Ӧ���õ�ClO3����Cl������������������ķ�Ӧ�У�![]() ��
��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
��������������״����112 mL���弴0.005mol����������ת��Ϊ0.005mol��4 =0.02mol������������0.02mol�����������������ʴ�Ϊ��0.02��

 �Ķ��쳵ϵ�д�
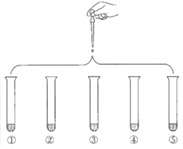
�Ķ��쳵ϵ�д�����Ŀ����5mL 0.005mol/L FeCl3��Һ��5mL 0.015mol/L KSCN��Һ��ϣ��ﵽƽ���ʺ�ɫ���ٽ����Һ��Ϊ5�ݣ��ֱ��������ʵ�飺����˵������ȷ���ǣ�������
| ʵ��٣��μ�4��ˮ���� |
ʵ��ڣ��μ�4�α���FeCl3��Һ���� | |
ʵ��ۣ��μ�4��1 mol/L KCl��Һ���� | |
ʵ��ܣ��μ�4��1 mol/L KSCN��Һ���� | |
ʵ��ݣ��μ�4��6 mol/L NaOH��Һ���� |
A.�Ա�ʵ��ٺ͢ڣ�Ϊ��֤�����ӷ�Ӧ��Ũ�ȣ�ƽ�ⷢ�������ƶ�
B.�Ա�ʵ��ٺۣ͢�Ϊ��֤�����ӷ�Ӧ��Ũ�ȣ�ƽ�ⷢ�������ƶ�
C.�Ա�ʵ��ٺ͢ܣ�Ϊ��֤�����ӷ�Ӧ��Ũ�ȣ�ƽ�ⷢ�������ƶ�
D.�Ա�ʵ��ٺ͢ݣ�Ϊ��֤�����ٷ�Ӧ��Ũ�ȣ�ƽ�ⷢ�������ƶ�
����Ŀ���ұ�����Ҫ�Ļ�����Ʒ��ij���������Ʊ��ұ�:������������:
�ټ����л���ķе����±�:
�л��� | �� | ������ | �ұ� |
�е�/�� | 80 | 38.4 | 136.2 |
�ڻ�ѧԭ��: ![]() +CH3CH2Br
+CH3CH2Br![]()
![]() +HBr��
+HBr��
���Ȼ������������׳��⡣
I���Ʊ��Ȼ���
��ͬѧѡ������װ���Ʊ��Ȼ�����װ�ò����ظ�ʹ�ã�:

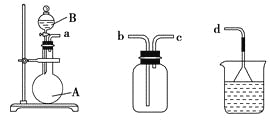
��1����ʵ���Ʊ������ķ���װ�õIJ���������________�֡�
��2������װ��֮��,���װ�õ������ԣ�װҩƷ���ȵ�ȼA���ƾ��ƣ���___________ ʱ����ʵ������ȼF���ƾ��ơ�
��3���������������Ǵ������ң�װ�õ��ܽӿ�����˳��a��______��k��i��f��g��_____��
��4��Dװ�ô�������ȱ�ݣ������Ľ������µ�ʵ������______________��
II.�Ʊ��ұ�

��ͬѧ���ʵ�鲽������:
����1������װ�ò���������ԣ���ͼ��ʾ���г�װ��ʡ�ԣ���
����2���þƾ�������ƿ��
����3������ƿ�м���������ˮ�Ȼ����������ı��������顣
����4�����ȣ���ַ�Ӧ��Сʱ��
����5���ᴿ��Ʒ��
�ش���������:
��5����ʵ����ȷ�ʽ�˲���_______ �������ƾ���ֱ�Ӽ���������ˮԡ����������
��6��ȷ�ϱ�ʵ��A���ѷ����˷�Ӧ���Լ�������___��
A ��������Һ B ʯ����Һ
C Ʒ����Һ D ����������Һ
��7���ᴿ��Ʒ�IJ��������У�
�ٹ��ˣ� ����ϡ����ϴ�ӣ� ����������ˮˮϴ �ܼ��������ˮ�Ȼ��ƣ����ô���ˮϴ�� �������ռ�136.2����� �߷�Һ��
�������Ⱥ�˳��Ϊ�ݢ�__ __��__ __�ޣ����������ţ���