题目内容
1.硼酸(H3BO3)在玻璃制造和医药领域应用广泛.其溶液中存在如下反应:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
计算25℃时0.7mol•L-1 硼酸溶液中H+的浓度.(写出计算过程,结果保留小数后一位)
分析 依据H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq)K=5.7×10-10(298K)可知,硼酸在25℃时的电离平衡常数为:5.7×10-10,依据三段法计算即可.
解答 解:H3BO3 (aq)+H2O (l)?[B(OH)4]-(aq)+H+(aq)
c起始/mol•L-1:0.70 0 0
△c/mol•L-1:x x x
c平衡/mol•L-1:0.70-x x x
K=$\frac{{c({{[B(OH{)_4}]}^-})•c({H^+})}}{{c({H_3}B{O_3})}}$═$\frac{x×x}{0.70-x}$=5.7×10-10,x2=3.99×10-10,解x=2.0×10-5(mol•L-1),
答:25℃时0.7mol•L-1 硼酸溶液中H+的浓度为2.0×10-5(mol•L-1).
点评 本题主要考查了弱电解质的电离,明确酸的电离平衡常数公式,熟练运用三段法解题是关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列各项操作错误的是?( )
| A. | 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层则从上口倒出 | |
| C. | 萃取、分液前需对分液漏斗时行检漏 | |
| D. | 用酒精萃取溴水中的碘单质的操作,可选用分液漏斗而后静置分液 |
12.下列数据是有机物的式量,可能是同系物的一组是( )
| A. | 16、30、58、72 | B. | 16、28、40、52 | C. | 16、32、48、54 | D. | 16、30、42、56 |
9.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是( )
| A. | 弱碱的浓度大于强酸的浓度 | |
| B. | 反应后的溶液呈酸性 | |
| C. | 原氨水中有1%的含氮微粒为NH4+ | |
| D. | 反应后的溶液中NH4+、NH3•H2O与NH3为0.05mol.L-1 |
16.下列溶液,一定呈中性的是( )
| A. | c(H+)=1×10-7mol/L的溶液 | |
| B. | pH=pOH的溶液(pOH是OH-浓度的负对数) | |
| C. | pH=14-pOH的溶液 | |
| D. | 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液 |
13.某有机物的分子结构如下表示:CH3-C≡C-CH=CH-C6H4-CH3,该分子中最多可以有多少个原子共平面( )
| A. | 22 | B. | 21 | C. | 20 | D. | 19 |
10.下列物质露置在空气中,质量会减轻的是( )
| A. | NaOH | B. | 浓H2SO4 | C. | Na2O2 | D. | 浓盐酸 |
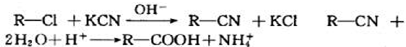
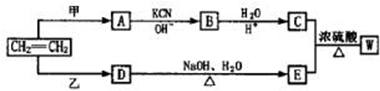
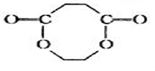 ,若W为一高分子化合物,其结构简式为
,若W为一高分子化合物,其结构简式为 .
.