题目内容
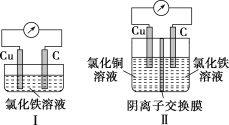
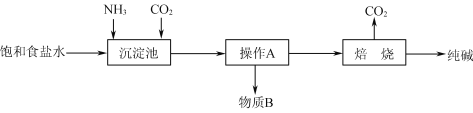
【题目】阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:
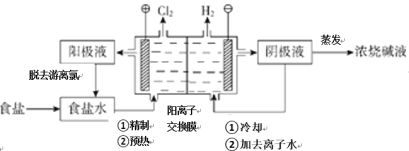
(1)电解饱和食盐水的化学方程式为______。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是_____(填字母序号)。
a.Na2SO4 b.Na2SO3
c.热空气吹出 d.降低阳极区液面上方的气压
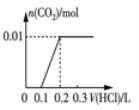
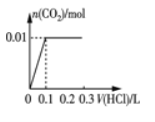
(3)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。
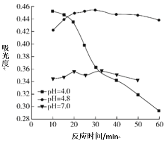
①结合化学用语解释10 min时不同pH体系吸光度不同的原因:______。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:____。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。现将1m3含I- 浓度为1.47 mgL-1 的食盐水进行处理,为达到使用标准,理论上至少需要0.05 molL-1 NaClO溶液_____L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)
【答案】2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH bcd 10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高,吸光度越大 c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降 0.1
Cl2↑+H2↑+2NaOH bcd 10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高,吸光度越大 c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降 0.1
【解析】
(1)氯碱工业电解的总方程式为:2NaCl+2H2O![]() C12↑+H2↑+2NaOH;
C12↑+H2↑+2NaOH;
(2)电解结束后,能够脱去阳极液游离氯的试剂或方法的选择,考查氯气的化学性质,从氯气的强氧化性和温度、压强与气体溶解度的关系答题;
(3)①吸光度越高表明该体系中c(I2)越大,ClO-+2H++2I-=I2+Cl-+H2O,10min时,pH越低,c(H+)越大,反应速率加快,c(I2)越高,吸光度越大;
②pH=4时,体系的吸光度很快达到最大值,之后快速下降是因为:c(H+)较高,ClO-继续将I2氧化为高价态含碘微粒,使c(I2)降低,吸光度下降;
③依据化学方程式进行计算。
(1)图为氯碱工业基本原理图,阳极产物为氯气,阴极产物为烧碱和氢气,电解的总方程式为:2 NaCl+2H2O![]() C12↑+H2↑+2NaOH;
C12↑+H2↑+2NaOH;
(2)a.Na2SO4与氯气不反应,故a不能脱去阳极液游离氯;
b.Na2SO3与氯气反应,Na2SO3+Cl2+H2O=Na2SO4↓+2HCl,故b能脱去阳极液游离氯;
c.温度升高气体溶解度减小,热空气吹出,故c能脱去阳极液游离氯;
d.降低阳极区液面上方的气压,气体溶解度减小,故d能脱去阳极液游离氯;
故答案为:bcd;
(3)①吸光度越高表明该体系中c(I2)越大,ClO+2H++2I=I2+Cl+H2O,10min时,pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高,吸光度越大;
②pH=4时,体系的吸光度很快达到最大值,之后快速下降是因为:c(H+)较高,ClO继续将I2氧化为高价态含碘微粒,使c(I2)降低,吸光度下降;
③根据题意,为达到使用标准,现将1m3含c(I)为1.47mgL1的食盐水进行处理,发生反应为ClO+2H++2I=I2+Cl+H2O,将溶液中c(I)调节最大为0.2 mgL-1,设理论上至少需要0.05molL1NaClO溶液的体积为VL,则参与反应的碘离子的物质的量=碘离子总物质的量-剩余碘离子的物质的量=![]() =
=![]() mol,根据反应方程式列式计算:
mol,根据反应方程式列式计算:
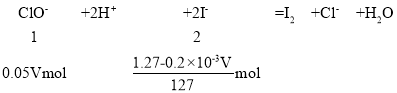
则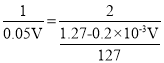 ,解得V=0.1L。
,解得V=0.1L。

 阅读快车系列答案
阅读快车系列答案