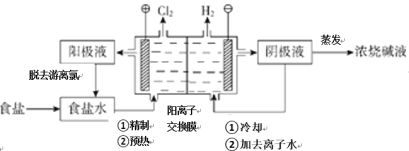
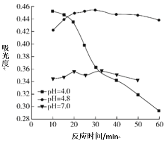
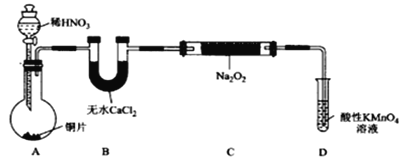
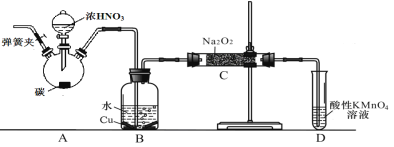
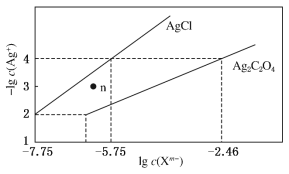
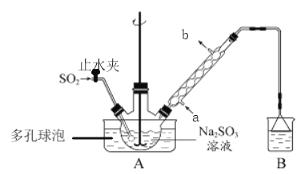
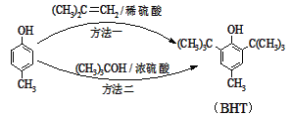
题目内容
【题目】一定温度下在一个2 L的恒容密闭容器中发生反应4A(s)+3B(g)![]() 2C(g)+D(g),经2 min达平衡状态,此时B反应消耗了0.9 mol,下列说法正确的是
2C(g)+D(g),经2 min达平衡状态,此时B反应消耗了0.9 mol,下列说法正确的是
A. 平衡时,v(A)∶v(B)∶v(C)∶v(D) =4∶3∶2∶1
B. 混合气的平均相对分子质量可作为平衡标志
C. 充入惰性气体使压强增大可加快反应速率
D. C的平均反应速率为0.5 mol/(L·min)
【答案】B
【解析】
经2min达平衡状态,此时B反应消耗了0.9mol,则
4A(s)+3B(g)2C(g)+D(g),
开始(mol) m n 00
转化(mol) 1.2 0.9 0.6 0.3
平衡(mol) m-1.2 n-0.9 0.6 0.3
结合化学反应速率和化学平衡的影响因素分析解答。
A.平衡时,v(B)∶v(C)∶v(D)=3∶2∶1,A为固体,不能用浓度的变化表示反应速率,故A错误;
B.气体的物质的量不变,但气体的质量为变量,根据![]() =
=![]() ,气体的平均相对分子质量为变量,则气体的平均相对分子质量不变,可作为平衡标志,故B正确;
,气体的平均相对分子质量为变量,则气体的平均相对分子质量不变,可作为平衡标志,故B正确;
C.充入惰性气体使压强增大,由于密闭容器的体积不变,则各组分的浓度不变,则反应速率不变,故C错误;
D.根据上述分析,经2min达平衡状态,此时B反应消耗了0.9mol,则生成0.6molC,C的平均反应速率为 =0.15mol/(Lmin),故D错误;
=0.15mol/(Lmin),故D错误;
答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目