题目内容
【题目】实验室常用以下方法制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
(1)用双线桥标出电子转移方向和数目 .
(2)在标准状况下生成的Cl2为11.2L时,参加反应的HCl的物质的量为 , 被氧化HCl的质量为 .
(3)为保证实验安全,常用NaOH溶液吸收多余的氯气.
①写出反应的离子方程式;
②当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2molL﹣1的NaOH溶液的体积至少应为多少?(写出计算过程)
【答案】
(1)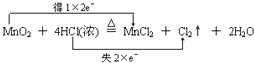
(2)2mol;36.5g
(3)
①Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
②4分钟时n(Cl2)= ![]() ×4=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
×4=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
需要n(NaOH)=0.4mol,
所以V(NaOH)= ![]() =0.2L=200mL,
=0.2L=200mL,
答:NaOH溶液的体积至少应为200mL.
【解析】解:(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O反应中锰元素化合价变化:+4→+2,氯化氢中部分氯元素化合价变化:﹣1→0,消耗1mol二氧化锰,转移4mol电子,用双线桥表示为:
MnCl2+Cl2↑+2H2O反应中锰元素化合价变化:+4→+2,氯化氢中部分氯元素化合价变化:﹣1→0,消耗1mol二氧化锰,转移4mol电子,用双线桥表示为: 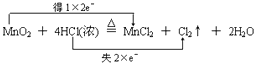 ,所以答案是:
,所以答案是: 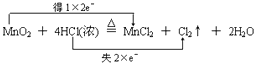 ;(2)标况下11.2LCl2的物质的量为
;(2)标况下11.2LCl2的物质的量为 ![]() =0.5mol,此反应中HCl和Cl2的化学计量数之比为4:1,则参加反应的HCl的物质的量为0.5mol×4=2mol,反应中被氧化的HCl为参加反应HCl的物质的量的
=0.5mol,此反应中HCl和Cl2的化学计量数之比为4:1,则参加反应的HCl的物质的量为0.5mol×4=2mol,反应中被氧化的HCl为参加反应HCl的物质的量的 ![]() ,则被氧化HCl的物质的量为2mol×
,则被氧化HCl的物质的量为2mol× ![]() =1mol,质量为1mol×36.5g/mol=36.5g;所以答案是:2mol;36.5g.(3)①氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
=1mol,质量为1mol×36.5g/mol=36.5g;所以答案是:2mol;36.5g.(3)①氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
【考点精析】利用氯气的实验室制法对题目进行判断即可得到答案,需要熟知实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O.

 习题精选系列答案
习题精选系列答案