题目内容
【题目】己知 l00mL 某无色溶液 X 可能由K+、Mg2+、Ba2+、Al3+、Fe2+、AlO2-、CO32- 、SO42-、I-、SiO32-、MnO4-中的若干种离子组成。某化学兴趣小组通过下列实验确定了其组成:
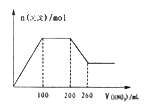
I .取适量该溶液,加入过量1.0 mol·L-1的硝酸,有气体生成,并得到无色溶液。该过程中产生沉淀的物质的量与加入的硝酸溶液体积的关系如上图所示。
II.将I过滤,在所得滤液中再加入过量的碳酸氢铵溶液,有气体生成,析出白色沉淀A;
III.在II所得溶液中逐滴加入氢氧化钡溶液至过量,加热有气体生成,同时析出白色沉淀B;
IV.向沉淀B中加入过量稀盐酸,沉淀部分溶解,将剩余沉淀过滤、洗涤、干燥后称重为 2.33 克,
根据以上实验事实推断:
(1)原溶液中一定含有的离子是___________________________。
(2)上述实验步骤II中产生白色沉淀A的离子方程式是________________________。
(3)白色沉淀B的成分是______________________________。
(4)原溶液中阳离子物质的量浓度为_____________________________。
【答案】 K+、AlO2-、CO32- 、SO42-、SiO32- A13++3HCO3-= Al(OH)3 ↓+ 3CO2↑ BaCO3、BaSO4 2.2mol/L
【解析】⑴.因溶液X无色,所以一定没有Fe2+和MnO4-,加入过量硝酸后得到无色溶液,则一定没有I-,加入硝酸后有气体生成,因在所给的离子组中只有CO32-遇硝酸反应生成气体,说明溶液中一定含有CO32-,则能与CO32-反应的Mg2+、Ba2+、Al3+一定不存在,根据溶液电中性原则,溶液中一定含有K+,根据图象可知,一开始加入硝酸就有沉淀生成,说明溶液中含有SiO32-,加入200mL的硝酸后,沉淀又能够部分溶解,说明溶液中一定含有AlO2-,在II所得溶液中逐滴加入氢氧化钡溶液至过量,析出白色沉淀B,向沉淀B中加入过量稀盐酸,沉淀部分溶解,说明原溶液中一定含有SO42-,根据上述分析可知,溶液中一定含有的离子是:K+、AlO2-、CO32- 、SO42-、SiO32-;
⑵.原溶液中含有AlO2-,加入过量的硝酸后过滤,得到的滤液中含有Al3+,再向滤液中加入碳酸氢铵溶液,铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为:A13++3HCO3-= Al(OH)3 ↓+ 3CO2↑;
⑶.根据上述分析可知,原溶液中含有CO32- 、SO42-,因此加入氢氧化钡溶液后生成的白色沉淀中含有BaCO3、BaSO4,故答案为:BaCO3、BaSO4;
⑷.原溶液中一定含有K+、AlO2-、CO32- 、SO42-、SiO32-,结合图象可知,加入260mL硝酸后恰好完全反应,所得的溶液中含有K+、A13+、NO3-、SO42-,n(NO3-)=n(HNO3)=0.26L×1.0 mol·L-1=0.26mol,n(SO42-)=n(BaSO4)=2.33g÷233g/mol=0.01mol,根据Al(OH)3+3HNO3=Al(NO3)3+3H2O可知,n(A13+)=n(Al(OH)3)=n(HNO3)÷3=0.06L×1.0 mol·L-1÷3=0.02mol,根据溶液电中性原则,有n(K+)+3×n(A13+)= n(NO3-)+2×n(SO42-),则n(K+)=n(NO3-)+2×n(SO42-)-3×n(A13+)=0.26mol+2×0.01mol-0.02mol×3=0.22mol,则c(K+)=0.22mol÷0.1L=2.2mol/L,故答案为:2.2mol/L。

 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案