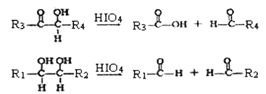
题目内容
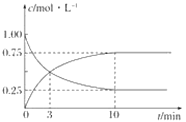
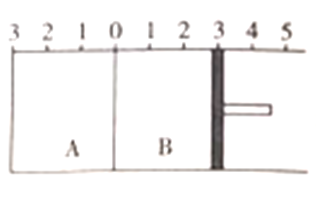
【题目】向x mL 0.01 mol·L-1氨水中滴加等物质的量浓度的H2SO4溶液,测得混合溶液的pOH[pOH= -lgc(OH-)]、温度随着加入的硫酸溶液体积的变化如图所示,下列说法正确的是( )。
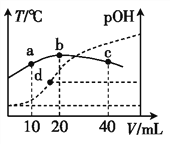
A. x=20
B. b点时溶液的pOH=pH
C. c点对应的溶液中:c(S![]() )>c(N
)>c(N![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D. a、b、d三点NH3·H2O的电离常数:K(b)>K(d)>K(a)
【答案】D
【解析】A. 由图象可知,b点温度达到最高,所以两者恰好完全反应,由于两者物质的量浓度相同,而硫酸是二元酸,所以x=40,A不正确;B. b点时溶液为硫酸铵溶液,因铵根离子水解使溶液呈酸性,c(H+)> c(OH-),所以pOH>pH,B不正确;C. c点对应的溶液中含有等物质的量的硫酸和硫酸铵,硫酸完全电离,铵根离子发生水解,溶液呈酸性,所以c(S![]() )> c(H+)>c(N
)> c(H+)>c(N![]() )> c(OH-),C不正确;D. NH3·H2O的电离是吸热过程,所以其电离常数随温度升高而增大,a、b、d三点NH3·H2O的电离常数大小关系为K(b)>K(d)>K(a),D正确。本题选D。
)> c(OH-),C不正确;D. NH3·H2O的电离是吸热过程,所以其电离常数随温度升高而增大,a、b、d三点NH3·H2O的电离常数大小关系为K(b)>K(d)>K(a),D正确。本题选D。

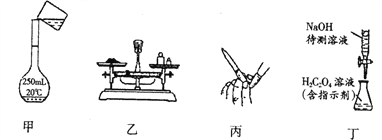
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
(1)配制100mL0.100molL-1 NaOH标准溶液。
① 主要操作步骤:计算→称量→溶解→_______(冷却后)→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
② 称量_____g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、________、烧杯(或表面皿)。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用配制的标准NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.100 | 22.18 | 20.00 |
2 | 0.100 | 22.22 | 20.00 |
3 | 0.100 | 22.20 | 20.00 |
①该实验滴定达到终点的标志是_____________________________。
②根据上述数据,可计算出该盐酸的浓度约为_________________(保留三位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______________。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH固体时,混入少量KOH杂质
④现用以上实验配制的0.10 molL-1NaOH溶液测定食醋中乙酸的浓度,应该选用的指示剂为_______。