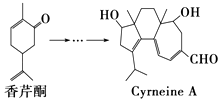
题目内容
【题目】某温度下,已知醋酸的电离常数Ka=1.6×10-5,醋酸银的溶度积Ksp(CH3COOAg)=3.7×10-3。下列有关说法正确的是
A. 醋酸溶液中,c(CH3COO-)>c(H+)>c(OH-)
B. 将相同浓度的CH3COOH溶液与CH3COO Na溶液等体积混合,所得溶液呈碱性
C. 该温度下,1mol/L的醋酸溶液中,醋酸的电离度为0.4%
D. 该温度下,浓度均为0.02mol/L的CH3COONa溶液和AgNO3溶液等体积混合(忽略混合后溶液体积的变化),有CH3COOAg沉淀生成
【答案】C
【解析】醋酸溶液存在电离平衡:CH3COOH![]() CH3COO-+H+和H2O
CH3COO-+H+和H2O![]() H++OH-,从中可知:c(H+)>c(CH3COO-) >c(OH-),A错误;CH3COO Na溶液水解平衡常数为Kh=KW/Ka=10-14/1.6×10-5=6.25×10-10,而CH3COOH的电离常数Ka=1.6×10-5,所以醋酸的电离能力大于醋酸钠的水解能力,因此将相同浓度的CH3COOH溶液与CH3COONa溶液等体积混合,所得溶液呈酸性,B错误;根据电离方程式CH3COOH
H++OH-,从中可知:c(H+)>c(CH3COO-) >c(OH-),A错误;CH3COO Na溶液水解平衡常数为Kh=KW/Ka=10-14/1.6×10-5=6.25×10-10,而CH3COOH的电离常数Ka=1.6×10-5,所以醋酸的电离能力大于醋酸钠的水解能力,因此将相同浓度的CH3COOH溶液与CH3COONa溶液等体积混合,所得溶液呈酸性,B错误;根据电离方程式CH3COOH![]() CH3COO-+H+,假设1mol/L的醋酸溶液中,醋酸的电离度为0.4%,即有4×10-3 mol/L CH3COOH分子发生电离,产生的氢离子和醋酸根离子的浓度均为4×10-3 mol/L ,则醋酸的电离常数Ka=c(H+)×c(CH3COO-)/ c(CH3COOH)= 4×10-3×4×10-3/(1- 4×10-3)= 1.6×10-5,与题给醋酸平衡常数相同,C正确;溶液等体积混合,混合后c(CH3COO-)=0.01 mol/L,c(Ag+)=0.01 mol/L,根据CH3COOAg浓度商= c(Ag+)×c(CH3COO-)=0.01×0.01=1×10-4 <Ksp(CH3COOAg)=3.7×10-3,所以没有沉淀产生,D错误;正确选项C。
CH3COO-+H+,假设1mol/L的醋酸溶液中,醋酸的电离度为0.4%,即有4×10-3 mol/L CH3COOH分子发生电离,产生的氢离子和醋酸根离子的浓度均为4×10-3 mol/L ,则醋酸的电离常数Ka=c(H+)×c(CH3COO-)/ c(CH3COOH)= 4×10-3×4×10-3/(1- 4×10-3)= 1.6×10-5,与题给醋酸平衡常数相同,C正确;溶液等体积混合,混合后c(CH3COO-)=0.01 mol/L,c(Ag+)=0.01 mol/L,根据CH3COOAg浓度商= c(Ag+)×c(CH3COO-)=0.01×0.01=1×10-4 <Ksp(CH3COOAg)=3.7×10-3,所以没有沉淀产生,D错误;正确选项C。

【题目】实验室制乙酸乙酯得主要装置如图A所示,主要步骤①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
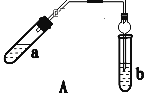
请回答下列问题:
(1) 步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:___。
(2) A装置中使用球形管除起到冷凝作用外,另一重要作用是___,步骤⑤中分离乙酸乙酯必须使用的一种仪器是___。
(3) 为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图A所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
实验 编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
A | 3 mL乙醇、2 mL乙酸、1mL 18mol·L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6 mL 3mol·L-1H2SO4 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是__mL和___mol·L-1。
②分析实验___(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是___。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是___。
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为__ (填字母)。
A.P2O5B.无水Na2SO4C.碱石灰D.NaOH固体