题目内容
【题目】铂(Pt)及其化合物用途广泛。
(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于 ______。
A.s区 B.p区 C.d区 D.ds 区 E.f区
(2)二氯二吡啶合铂是由Pt2+ 、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同 分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的外围电子排布式为 ______。
②吡啶分子是大体积平面配体,其结构简式如右图所示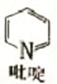 ,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是 ___、____,各元素的电负性由大到小的顺序为_______。
,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是 ___、____,各元素的电负性由大到小的顺序为_______。
③二氯二吡啶合铂分子中存在的微粒间作用力有 _____(填序号)。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由: ________。
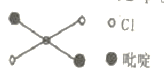
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是 _____分子(选填“极性”、“非极性”)。
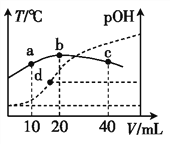
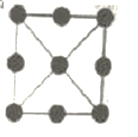
(3)金属铂立方晶胞沿 x、y或z轴的投影图如右图所示。若金属铂的密度为d g·cm-3,则晶胞参数a=_____nm(列出计算式即可)。
【答案】 C 3s23p6 N sp2 sp2 N、C、H b、d 若Pt2+以sp3杂化轨道进行配位,则二氯二吡啶合铂为四面体结构,不存在顺反异构体 非极性 ![]()
![]()
【解析】(1). 在元素周期表中,铂元素与铁元素同族,铁元素位于元素周期表的d区,所以铂元素也位于d区,故答案选C;
(2). ①.Cl-核外有18个电子,其外围电子排布式为:3s23p6,故答案为:3s23p6;
②. 在吡啶分子中,由N原子提供孤电子对形成配体,所以该配体的配位原子是N原子,在吡啶分子中,碳原子形成2个单键和1个双键,共3个σ键,氮原子形成1个单键、1个双键和1个配位键,共3个σ键,所以碳、氮原子的轨道杂化方式分别是sp2、sp2,吡啶由N、C、H三种元素组成,因非金属性N>C>H,所以电负性由大到小的顺序为:N、C、H,故答案为:N;sp2;sp2;N、C、H;
③.二氯二吡啶合铂分子是由Pt2+ 、Cl-和吡啶结合形成的铂配合物,所以存在配位键,碳原子之间形成非极性键,因二氯二吡啶合铂属于分子,所以不存在离子键和金属键,又因氮原子未连接氢原子,所以不存在氢键,故答案为:b、d;
④. 二氯二吡啶合铂有顺式和反式两种同分异构体,在二氯二吡啶合铂分子中,若Pt2+以sp3杂化轨道进行配位,则二氯二吡啶合铂为四面体结构,不存在顺反异构体,所以Pt2+的配位数虽然是4,但是其轨道杂化方式并不是sp3,故答案为:若Pt2+以sp3杂化轨道进行配位,则二氯二吡啶合铂为四面体结构,不存在顺反异构体;
⑤. 吡啶分子是大体积平面配体,由反式二氯二吡啶合铂分子的结构示意图可知,该分子的结构是一种对称结构,所以反式二氯二吡啶合铂分子是非极性分子,故答案为:非极性;
(3). 由金属铂立方晶胞的投影示意图可知,金属铂是面心立方最密堆积结构,则一个晶胞中含有8×1/8+6×1/2=4个Pt原子,则金属铂的密度d gcm-3= ,a=
,a=![]() nm或
nm或![]() ×10-7nm,故答案为:
×10-7nm,故答案为:![]() 或
或![]() ×10-7。
×10-7。