题目内容
【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是___(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能 e.天然气 f.氢能
(2)甲烷裂解法制取乙炔反应的化学方程式为2CH4(g)![]() C2H2(g)+3H2(g)。
C2H2(g)+3H2(g)。
①已知下列化学键的键能数据:
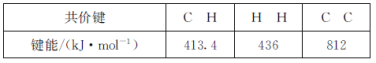
则反应2CH4(g)![]() C2H2(g)+3H2(g)的△H=___kJ·mol-1。
C2H2(g)+3H2(g)的△H=___kJ·mol-1。
②燃烧agCH4生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的CO2与足量澄清石灰水反应得到5g沉淀,则CH4(g)+2O2(g)![]() CO2(g)+2H2O(l)△H1=___kJ·mol-1,a=___。
CO2(g)+2H2O(l)△H1=___kJ·mol-1,a=___。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨的稳定性较大的是___(填“金刚石”或“石墨”);石墨的燃烧热为___kJ·mol-1。
②12g石墨在-定量空气中燃烧,生成36g气体,该过程放出的热量为___kJ。
【答案】ae +360.4 -890 0.8 石墨 393.5 252.0
【解析】
(1)新能源是指无污染、可以持续利用的能源,包括太阳能、风能、核能、地热能、潮汐能等;
(2)①根据△H=反应物的总键能-生成物的总键能进行计算;
②agCH4生成二氧化碳气体和液态水,放出热量44.5kJ,根据生成沉淀的质量计算出CO2的物质的量,进一步计算出agCH4的物质的量,最终计算1molCH4生成二氧化碳气体和液态水,放出的热量;
(3)①能量越低物质越稳定;1mol纯物质完全燃烧生成稳定氧化物时释放的能量为燃烧热;
②根据极值计算判断生成的气体的组成,结合热化学方程式计算。
(1)根据分析可知,太阳能、风能、地热能、氢能都是新能源,因此不属于新能源的是煤炭和天然气,答案选ae;
(2)①△H=反应物的总键能-生成物的总键=2×4×413.4kJ/mol-2×413.4kJ/mol-812kJ/mol-3×436kJ/mol=+360.4 kJ·mol-1;
②agCH4生成二氧化碳气体和液态水,生成的CO2与足量澄清石灰水反应得到5g沉淀,那么n(CaCO3)=n(CO2)=n(CH4)=![]() =0.05mol,即0.05mol(a=0.05mol×16g/mol=0.8g) CH4生成二氧化碳气体和液态水,放出热量44.5kJ,因此1mol CH4生成二氧化碳气体和液态水,放出热量
=0.05mol,即0.05mol(a=0.05mol×16g/mol=0.8g) CH4生成二氧化碳气体和液态水,放出热量44.5kJ,因此1mol CH4生成二氧化碳气体和液态水,放出热量![]() kJ=890 kJ,即CH4(g)+2O2(g) = CO2(g)+2H2O(l)△H1=-890kJ·mol-1,a=0.8;
kJ=890 kJ,即CH4(g)+2O2(g) = CO2(g)+2H2O(l)△H1=-890kJ·mol-1,a=0.8;
(3)①能量越低物质越稳定,由图象可知金刚石的能量高于石墨的能量,因此石金刚石和石墨中稳定性较大的是石墨;1mol石墨完全燃烧生成CO2放出的热量为110.5kJ+283.0kJ=393.5 kJ,因此石墨的燃烧热是393.5 kJ·mol-1
②12g石墨的物质的量为1mol,在一定量的空气中燃烧,根据元素守恒,若生成CO2,质量为44g,若生成CO,质量为28g,现生成的气体为36g,28g<36g<44g,说明生成的气体既有CO又有CO2,设生成的CO为xmol,生成的CO2为(1-x)mol,28x+44(1-x)=36,x=0.5mol,即生成的CO为0.5mol,CO2为0.5mol;1mol石墨燃烧生成CO放出的热量为110.5 kJ,那么0.5mol石墨燃烧生成CO放出的热量为55.25kJ,1mol石墨完全燃烧生成CO2放出的热量为393.5 kJ,那么0.5mol石墨完全燃烧生成CO2放出的热量为196.75 kJ,所以12g石墨在-定量空气中燃烧,生成36g气体,该过程放出的热量为55.25kJ+196.75kJ=252.0 kJ。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】纳米磷酸钙是理想的生物材料,可用作骨骼和牙用骨水泥。将含有脲酶的Na3PO4溶液加入处于高速搅状态的尿素[CO(NH2)2]、CaC12和盐酸混合液中,可制得纳米磷酸钙。
已知:①CO(NH2)2+H2O![]() 2NH3+CO2
2NH3+CO2
②25℃时,H3PO4的Ka1=7.5×10-3 、Ka2=6.3×10-8、Ka3=4.4×10-13;Ca3(PO4)2的Ksp=3.3×10-9。
(1)实验过程若降低搅拌速率,可能造成的不良后果是___________。
(2)尿素水解液呈碱性,则c(![]() )___________ c(
)___________ c(![]() )(填“>”或“<”)
)(填“>”或“<”)
(3)混合后,溶质的初始浓度如下表
物质 | CaCl2 | HCl | NaH2PO4 | NaCl | 尿素 | 脲酶 |
初始浓度 mol/L | 0.25 | 5×10-3 | 0.05 | 1 | 1.0 | 20U/mL |
①生成![]() 的离子方程式为___________。
的离子方程式为___________。
②初始时刻,溶液中含磷微粒浓度从大到小的顺序为___________。
③判断此时能否生成Ca3(PO4)2沉淀___________ (列式计算) 。
(4)上述实验条件下,溶液的浊度、pH与反应时间t的关系如图所示,实验表明,pH在7.8-8.1之间出现周期性振荡,相关分析不正确的是___________ (填序号) 。
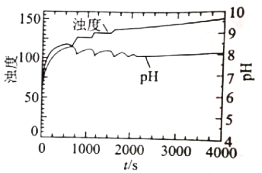
A.振荡周期内,PO43-浓度不变
B.随着尿素水解反应的进行,pH升高
C.随着磷酸钙沉淀的生成,pH下降
D.尿素水解速率和磷酸钙沉淀速率的差异引起pH周期性振荡
【题目】室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②