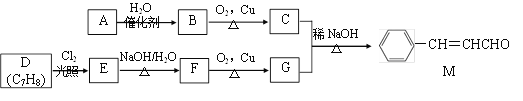
题目内容
【题目】对于恒容密闭容器中发生的可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为( )
2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为( )
A.断开一个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量
D.N2、H2、NH3分子数比为1∶3∶2
【答案】C
【解析】
A. 断开一个N≡N键的同时有6个NH键生成,则只表明反应正向进行,不能体现正逆反应速率相等,不能判断平衡状态,A错误;
B. 恒容密闭容器中,气体总质量和体积都不变,密度始终不变,不能判断平衡状态,B错误;
C. 该反应为反应前后气体分子数不同,气体的物质的量不同,气体的质量不变,混合气体平均相对分子质量不变,反应达到平衡状态,C正确;
D. 当体系达平衡状态时,N2、H2、NH3分子数比可能为1:3:2,也可能不是1:3:2,与各物质的初始浓度及转化率有关,不能判断平衡状态,D错误。
答案为C。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl②
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因___________________________;
(2)现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
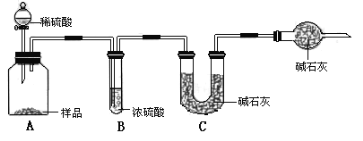
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2CaCl2+H2O+CO2↑)。完成三次实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。
请分析、计算后填表:
分析与 计算 分组 | 计算样品中碳酸钠 的质量分数 | 对实验结果 的评价 | 实验失败的主要原因 及对结果的影响 |
甲组 | _______________ | 失败 | ____________ |
乙组 | ____________ | 成功 | |
丙组 | ______________ | 成功 |