题目内容
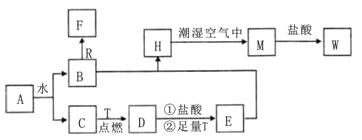
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图所示(部分产物已略去):
(1)写出B的电子式________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,写出A和B水溶液反应的离子方程式________。
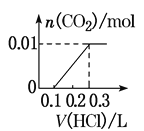
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图所示,则A与B溶液反应后溶液中溶质的化学式_____。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是__________。
(5)若A是一种氮肥, A和B反应可生成气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为_________。
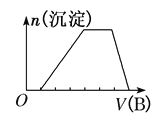
(6)若A是一种溶液,可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32- 、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子的物质的量浓度之比为______________。
【答案】![]() SiO2+2OH-====SiO32-+H2O NaHCO3、Na2CO3 先有白色沉淀生成,随后沉淀逐渐减少最终消失 3Cl2+8NH3===N2+6NH4Cl c(H+)∶c(Al3+)∶c(NH4+)∶c(SO42-)=1∶1∶2∶3
SiO2+2OH-====SiO32-+H2O NaHCO3、Na2CO3 先有白色沉淀生成,随后沉淀逐渐减少最终消失 3Cl2+8NH3===N2+6NH4Cl c(H+)∶c(Al3+)∶c(NH4+)∶c(SO42-)=1∶1∶2∶3
【解析】
由题给信息可知,C可在D中燃烧发出苍白色火焰,则该反应为氢气与氯气反应生成HCl,故C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由题给转化关系可知,M的溶液电解生成氢气、氯气与B,则M为NaCl、B为NaOH。
(1)B为NaOH,氢氧化钠是由钠离子和氢氧根离子组成的离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(3)若A是CO2气体,CO2与NaOH溶液能够反应生成碳酸钠或碳酸氢钠或两者的混合物,也有可能氢氧化钠过量,反应后所得的溶液再与盐酸反应,溶液中溶质只有碳酸钠,则碳酸钠转化为碳酸氢钠消耗盐酸体积与碳酸氢钠反应生成二氧化碳消耗盐酸体积相等,由图可知消耗盐酸体积之比为1:2,则CO2与NaOH溶液反应后溶液中溶质为Na2CO3和NaHCO3,故答案为:Na2CO3和NaHCO3;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解,故看到的现象为溶液中先有白色絮状沉淀生成,且不断地增加,随后沉淀逐渐溶解最终消失,故答案为:先有白色沉淀生成,随后沉淀逐渐减少最终消失;
(5)若A是一种化肥,实验室可用A和NaOH反应制取气体E,E与F相遇均冒白烟,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,且利用E与氯气的反应检验输送氯气的管道是否泄露,则E与D的反应为氨气与氯气反应生成氯化铵和氮气,反应方程式为:3Cl2+8NH3=N2+6NH4Cl,故答案为:3Cl2+8NH3=N2+6NH4Cl;
(6)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,发生反应H++OH-=H2O,氢离子消耗NaOH溶液的体积与Al3++3OH-=Al(OH)3↓铝离子消耗NaOH溶液的体积之比为1:3,发生反应NH4++OH-=NH3H2O,铵根消耗氢氧化钠为2体积,则n(H+):n(Al3+):n(NH4+)=1:1:2,由电荷守恒可知,n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3,故c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3,故答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D