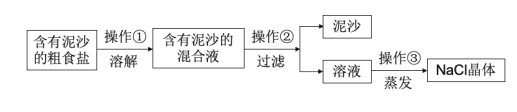
题目内容
【题目】CO2是重要的化工原理,也是应用广泛的化工产品。完成下列计算:
将2.50molCO2气体通过2.00LNaOH溶液中,CO2被完全吸收。取上述溶液20.0mL向该溶液中逐滴加入一定浓度的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
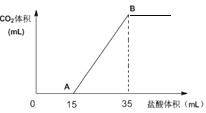
(1)当加入35mL盐酸时,产生二氧化碳的体积为_______mL(标准状况);
(2)吸收二氧化碳后,溶液中两种物质的物质的量之比为:_______。
【答案】560 n(Na2CO3):n(NaHCO3)=3:1
【解析】
CO2气体通过NaOH溶液中,可能发生的反应为:2NaOH+CO2=Na2CO3+H2O、NaOH+CO2=NaHCO3。滴加盐酸后,Na2CO3中发生的反应为:Na2CO3+HCl=NaCl+ NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑,若溶液中只含有Na2CO3,则从开始生成气体到反应完全,两个过程消耗的盐酸体积相同,若Na2CO3中混有NaHCO3,则后一阶段消耗的盐酸体积比前一阶段多。现20mL>15mL,所以溶液中的溶质为Na2CO3和NaHCO3的混合物。
(1)2.50molCO2气体通过2.00LNaOH溶液中,生成Na2CO3和NaHCO3共2.50mol,从中取出20.0mL,则Na2CO3和NaHCO3共为![]() =0.0250mol,n(CO2)=n(Na2CO3)+n(NaHCO3)= 0.0250mol,V(CO2)= 0.0250mol×22400mol/L=560mL。答案为:560;
=0.0250mol,n(CO2)=n(Na2CO3)+n(NaHCO3)= 0.0250mol,V(CO2)= 0.0250mol×22400mol/L=560mL。答案为:560;
(2)从反应中可以看出,Na2CO3与HCl反应生成NaHCO3时,消耗盐酸15mL,则生成的NaHCO3再与盐酸反应时,又消耗盐酸15mL,则原混合物中的NaHCO3消耗盐酸5mL,从而得出n(Na2CO3):n(NaHCO3)=c(HCl)×15mL:c(HCl)×5mL= 3:1。答案为:n(Na2CO3):n(NaHCO3)=3:1。