题目内容
【题目】有甲基、苯基、羟基、羧基四种基团,在它们两两组合形成的化合物中:
(1)能使石蕊试液变色的是_______________(只需写出一种物质的结构简式,下同);
(2)能与溴水反应的是____________;
(3)催化氧化后产物能与新制氢氧化铜反应的是_________________;
(4)能与氯化铁溶液反应的是__________________________;
(5)不同情况下与氢氧化钠反应能生成两种盐的是_______________。
【答案】CH3COOH(或C6H5COOH或HO-COOH) ![]() CH3OH
CH3OH ![]() HOCOOH
HOCOOH
【解析】
甲基、苯基、羟基、羧基四种基团两两组合对应的有机物有CH3COOH、![]() 、H2CO3、
、H2CO3、![]() 、CH3OH等,结合有机物官能团的性质分析解答。
、CH3OH等,结合有机物官能团的性质分析解答。
甲基、苯基、羟基、羧基四种基团两两组合对应的有机物有CH3COOH、![]() 、H2CO3、
、H2CO3、![]() 、CH3OH等。
、CH3OH等。
(1)能使石蕊试液变色的物质具有酸性,对应的有CH3COOH、![]() 、HO-COOH(H2CO3),苯酚不能使石蕊变色,故答案为:CH3COOH(或
、HO-COOH(H2CO3),苯酚不能使石蕊变色,故答案为:CH3COOH(或![]() 或HO-COOH);
或HO-COOH);
(2)能与溴水反应的是![]() ,与溴水发生取代反应生成三溴苯酚沉淀,故答案为:
,与溴水发生取代反应生成三溴苯酚沉淀,故答案为:![]() (或C6H5OH);
(或C6H5OH);
(3)催化氧化后产物能与新制氢氧化铜反应,说明产物中含有-CHO,只有CH3OH符合,故答案为:CH3OH;
(4)能与氯化铁溶液发生显色反应的是![]() ,反应后溶液显紫色,为
,反应后溶液显紫色,为![]() 的特征反应,故答案为:
的特征反应,故答案为:![]() ;
;
(5)不同情况下与氢氧化钠反应能生成两种盐的是HOCOOH(H2CO3),可生成Na2CO3或NaHCO3,故答案为:HOCOOH。

【题目】某混合溶液中可能大量含有的离子如下表所示:
阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
阴离子 | Cl-、OH-、CO32-、AlO2- |
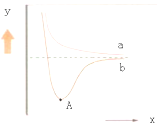
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。

(1)该溶液中一定含有的阳离子是________________________________,其对应物质的量浓度之比为 ____________,溶液中一定不存在的阴离子是_______________________。
(2)写出沉淀减少的离子方程式 ________________________________________________。
【题目】根据元素周期表中短周期的下列内容回答问题:
H | ① | ||||||
② | ③ | O | ④ | ||||
⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素①~⑨形成的单质中,化学性质最稳定的是_____(填化学式)。④在元素周期表中的位置是________,⑥的简单离子的结构示意图为________________
(2)③、⑨和H元素可形成一种常见的盐,其中存在的化学键类型为________________,⑤、⑧按原子个数比2:1形成的化合物的电子式为________________
(3)写出一个可证明②和⑦非金属性强弱的离子方程式:________________
(4)在酸性溶液中,②的简单氢化物与O2组成燃料电池,其负极的电极反应式为________________