��Ŀ����
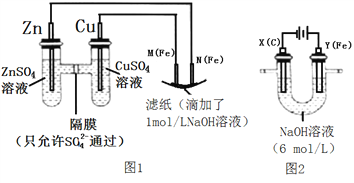
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����
��ش�
��������ͼ1��ʾװ�ý��е�һ��ʵ����
��1���ڱ�֤�缫��Ӧ���������£��������Cu���缫����_______������ĸ��ţ���
A. �� B. ʯī C. �� D. ��
��2��M��������Ӧ�ĵ缫��ӦʽΪ________��
��3��ʵ������У�SO42��________�����������������������������������������ƶ�����ֽ���ܹ۲쵽��������___________________��д������������ķ�Ӧ����ʽ��__________________��
��������ͼ2��ʾװ�ý��еڶ���ʵ����
��4��ʵ������У������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ�������������Ϸ��֣����������FeO42��������Һ�г��Ϻ�ɫ���������У�X������Һ��pH________������������������С����������������
��5���������У�Y�������ĵ缫��ӦΪFe��6e��+8OH���TFeO42��+4H2O �� 4OH����4e���T2H2O+O2��������X���ռ���672mL���壬��Y���ռ���168mL���壨��������Ϊ��״��ʱ�������������Y�缫�����缫����������________g��
��6���ڼ���п����У��ø��������Ϊ�������ϣ�����ܷ�ӦΪ��2K2FeO4+3Zn�TFe2O3+ZnO+2K2ZnO2 �õ�������ĵ缫��ӦʽΪ________��
���𰸡� A Fe��2e��+ 2OH��= Fe(OH)2 �������� ��ֽ���к��ɫ�ߵ���� 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 ���� 0.28 2FeO42��+ 6e��+ 5H2O �T Fe2O3 + 10OH��
������������(1)Ҫ��֤�缫��Ӧ���䣬�ܹ����Cu���缫�ı����DZ�Zn�����õĵ���������������Zn������������ʯī�����������������Cu��������������Zn���ã����Բ������Cu����������ȷ��ΪA��
(2)M����Cu��Znԭ��ص�����Cu������������������Ϊ���Խ����缫����ʧȥ��������Fe2+������Һ��OH���������Fe(OH)2�����Ե缫��ӦʽΪFe��2e��+2OH��= Fe(OH)2��
(3)��ԭ����ڲ��ĵ������Һ�У����������ƶ�������SO42��ͨ����Ĥ���������ƶ����ڵ���NaOH��Һ����ֽ�ϣ�M�����������ɵ�Fe(OH)2��Ѹ�ٱ�Ϊ����ɫ��Ȼ���Ϊ���ɫ��N�������������������۲첻������������ֽ���ܹ۲쵽���������ȱ����ɫ��Ȼ���Ϊ���ɫ����Ӧ�ķ���ʽΪ4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3��
����(4)��װ��ͼ��֪X(C)Ϊ������Y(Fe)Ϊ��������������֪��ʧȥ���ӽ��OH-�����ɸ��������FeO42������ʹ��Һ���Ϻ�ɫ��������X(C)������H+�õ���������������ʹ��Һ�е�c(H+)��С��pH������
(5)����X���ռ���672mL��������0.03mol����õ�����n(e��)=0.06mol, ��Y���ռ���168mL��������0.0075mol����ʧȥ����n(e��)=0.03mol�����ݵ���ת���غ�ɵã���ʧȥ�ĵ���n(e��)=0.03mol���ɵ缫��ӦʽFe��6e��+8OH���TFeO42��+4H2O��������ܽ���ٵ�����m(Fe)= ![]() = 0.28g��
= 0.28g��
(6)��Ϊ�Ǽ��Ե�أ�OH������Zn����ϵ�ص��ܷ�Ӧʽ��֪��������ӦʽΪ3Zn��6e��+ 10OH��= ZnO+2ZnO22- + 5H2O�����ܷ�Ӧʽ��������Ӧʽ����������ӦʽΪ2FeO42��+ 6e��+ 5H2O �T Fe2O3 + 10OH����




