题目内容
20.已知1molR2-中含质子16mol,一定质量的R2-中共含质子8mol,则其中所含的电子的物质的量为( )| A. | 10 mol | B. | 9 mol | C. | 8 mol | D. | 7 mol |
分析 1molR2-中含质子16mol,则1molR2-中含电子18mol,一定质量的R2-中共含质子8mol,R2-的物质的量为0.5mol,可计算含有电子物质的量.
解答 解:1molR2-中含质子16mol,则1molR2-中含电子18mol,一定质量的R2-中共含质子8mol,R2-的物质的量为0.5mol,含有电子物质的量为18mol×$\frac{0.5mol}{1mol}$=9mol,故选B.
点评 本题考查微粒数目有关计算,比较基础,关键是明确离子中电子数、质子数与电荷数关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.利用原料气在合成塔中合成NH3,为加快正反应速率,且提高N2的转化率所采取的措施是( )
| A. | 加压 | B. | 移走氨气 | C. | 使用催化剂 | D. | 充入N2 |
15.如图为铜锌原电池示意图,下列说法中正确的是( )


| A. | 锌片逐渐溶解 | B. | 烧杯中溶液逐渐呈蓝色 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 电解质溶液的pH保持不变 |
5.下列有关叙述正确的是( )
| A. | Na2O•SiO2是一种简单的硅酸盐,可溶于水 | |
| B. | 严重影响我国北方的霾尘,其颗粒物是种胶体 | |
| C. | 盐酸、NaCl溶液是实验室常见的电解质 | |
| D. | 酸性氧化物均能与水反应生成对应的酸,如CO2、SO3等 |
12.下列物质属于强电解质的是( )
| A. | NaCl溶液 | B. | BaSO4 | C. | Cu | D. | HClO |
18.由CO、H2和O2组成的混合气体,在一定条件下恰好完全反应,测得生成物在101kPa、120℃下对空气的相对密度为1.293,则原混合气体中CO所占体积分数为( )
| A. | $\frac{1}{3}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{2}$ | D. | $\frac{1}{6}$ |
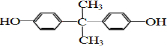
 ) 和某聚碳酸酯工程塑料(
) 和某聚碳酸酯工程塑料(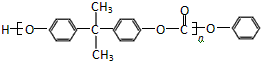 )的原料之一.
)的原料之一. →
→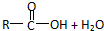
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(2n-1)ROH
+(2n-1)ROH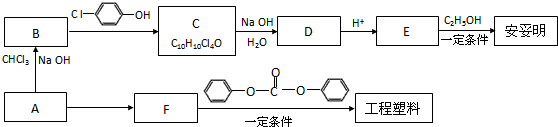
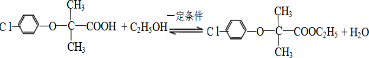 .
.
 .
.