题目内容
【题目】如图所示三套实验装置,分别回答下列问题。
图1
图2
图3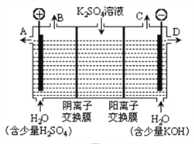
(1)图1中,① 若开始时开关K与a连接,则该装置为_____(填装置名称),电极A的电极反应式为________________________
②若开始时开关K与b连接,则总反应的离子方程式为___________________
(2)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图2所示:
①______极(填a或b)为电池的正极,电池工作时电子的流向为_________(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(3)用图3装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阴极反应式为_____________________。
②制得的硫酸溶液从出口__________________________(填“A”、“D”)导出,并简述原因__________________________(请用化学用语和文字解释)
【答案】原电池2H2O+O2+4e-=4OH-2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑b a→bC2H5OH-12e-+3H2O=12H++2CO22H2O+2e-=2OH-+H2↑ 或2H++2e-=H2↑A2H2O-4e-=4H++O2↑,OH-在阳极放电,使水的电离平衡正向移动,c(H+)增大SO42-通过阴离子交换膜进入阳极,和H+结合成硫酸
2OH-+H2↑+Cl2↑b a→bC2H5OH-12e-+3H2O=12H++2CO22H2O+2e-=2OH-+H2↑ 或2H++2e-=H2↑A2H2O-4e-=4H++O2↑,OH-在阳极放电,使水的电离平衡正向移动,c(H+)增大SO42-通过阴离子交换膜进入阳极,和H+结合成硫酸
【解析】
(1)①K与a连接形成原电池反应,发生吸氧腐蚀,B电极铁做负极失电子生成亚铁离子,A电极石墨做正极溶液中氧气得到电子生成氢氧根离子;
②K与b连接形成电解池,与电源正极相连的A电极为阳极,溶液中氯离子失电子生成氯气,与电源负极相连的B电极为电解池的阴极,溶液中氢离子得到电子生成氢气,电解氯化钠溶液生成氢氧化钠、氢气和氯气;
(2)在燃料电池中,燃料在负极发生失电子的反应,电流在电路中从正极流向负极;
(3)电解时,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,阳极上失电子发生氧化反应,电解产生的氢氧化钾在阴极产生.
(1)①K与a连接形成原电池反应,发生吸氧腐蚀,A电极石墨做正极溶液中氧气得到电子生成氢氧根离子,电极反应为:O2+2H2O+4e-=4OH-;
②K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,即B电极反应为2H++2e-=H2↑;电解饱和食盐水生成氢氧化钠、氢气和氯气,电解总反应的离子方程式为 2H2O+2Cl-![]() 2OH-+H2↑;
2OH-+H2↑;
(2)①燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,电流在电路中从正极流向负极,根据质子移动方向,可以知道b是正极,a是负极;
②该电池负极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+;
(3)①电解时,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑;
②阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑,阳极氢氧根离子放电,因此硫酸根离子向阳极移动,该电极上会产生硫酸,阴极氢离子放电,因此钾离子向阴极移动,电解产生的氢氧化钾在阴极生成,所以氢氧化钾溶液从出口D流出,制得的硫酸溶液从A口流出。即:制得的硫酸溶液从出口A流出,由于阳极2H2O-4e-=4H++O2↑,OH-在阳极放电,使水的电离平衡正向移动,c(H+)增大,SO42-通过阴离子交换膜进入阳极,和H+结合成硫酸。

 阅读快车系列答案
阅读快车系列答案