题目内容
【题目】NA代表阿伏加德罗常数的值,以下说法正确的是( )
A.将足量Zn与100mL18mol/L 浓硫酸反应,生成224mL气体,转移电子为0.02NA
B.32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA
C.1 mol Na2O2固体中含离子总数与1 mol CH4中所含共价键数目相等
D.常温常压下,92 g的NO2和N2O4混合气体中含有的氮原子数为3NA
【答案】B
【解析】
A.生成的气体所处的状态不明确,故其物质的量无法计算,则转移的电子数无法计算,故A错误;
B.32g铜的物质的量为n= ![]() =0.5mol,而铜与浓、稀硝酸反应后均变为+2价,故0.5mol铜反应失去NA个电子,由电子得失守恒可知,浓、稀硝酸得电子数均为NA个,故B正确;
=0.5mol,而铜与浓、稀硝酸反应后均变为+2价,故0.5mol铜反应失去NA个电子,由电子得失守恒可知,浓、稀硝酸得电子数均为NA个,故B正确;
C.过氧化钠由钠离子和过氧根离子构成,故1mol过氧化钠中含3NA个离子;甲烷中含4个C—H键,故1mol甲烷中含4NA个共价键,1 mol Na2O2固体中含离子总数与1 mol CH4中所含共价键数目不相等,故C错误;
D.常温常压下,92 g的NO2和N2O4混合气体中设NO2的物质的量为x,设N2O4的物质的量为y,由质量列出方程为46x+92y=92,解得x+2y=2,则92 g的NO2和N2O4混合气体中含有的氮原子的物质的量为x+2y=2(mol),含有的氮原子的数为2NA,故D错误;
答案为B。

【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
请回答下列问题:
(1)H2CO3的第二级电离平衡常数的表达式K2=______。
(2)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为____。
(3) 用足量Na2CO3溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为____。
(4)25℃时,向0.1 molL-1的氨水中缓缓少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是______。
A. B.
B.
C.  D.
D.
(5)能证明醋酸是弱酸的实验事实是______(填写序号)。
① 相同条件下,浓度均为0.1 molL-1的盐酸和醋酸,醋酸的导电能力更弱
② 25℃时,一定浓度的CH3COOH、CH3COONa混合溶液的pH等于7
③ CH3COOH溶液能与NaHCO3反应生成CO2
④ 0.1molL-1 CH3COOH溶液可使紫色石蕊试液变红
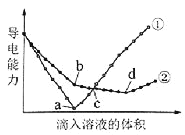
(6)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示。

① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是______。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)