题目内容
【题目】.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的处理。某工厂欲以工业废料(金属铝、铁及其氧化物)为原料制取PAFC,设计如下流程:

(1)PAFC中铁元素的化合价为_________。
(2)废料与稀盐酸混合后发生了多个化学反应,在发生的这些反应中,请写出一个是氧化还原反应但不属于四大基本反应类型的反应的离子方程式______________________________。
(3)所得酸性溶液中,不能确定是否一定存在的阳离子是___________,欲确认该离子是否存在最常用的试剂名称为____________________。
(4)试剂X最好是下列中的__________
A.Fe B.HNO3 C.氯水 D.高锰酸钾溶液
(5)水解形成的聚合物分散在水中的粒子直径在1nm~100nm之间,请用简单的实验操作验证该分散系 ____________________________________________________________________________。
Ⅱ.为检测PAFC中Al和Fe含量,采用如图所示流程进行。
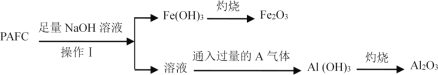
回答下列问题:
(6)操作I的名称______________________。
(7)通入过量的A气体的离子方程式为 ______________。
【答案】 +3 Al+3Fe3+=Al3++3Fe2+ Fe3+ 硫氰化钾溶液 C 用一束光通过混合物,可以看到一条光亮的“通路”,产生丁达尔现象 过滤 AlO2+CO2+2H2O=Al(OH)3↓+HCO3
【解析】(1)设铁化合价是x,聚合氯化铝铁可表示为[AlFe(OH)nCl6-n]m,由此合物内化合价和为0得:3+x-n-(6-n)=0;x=3,所以PAFC中铁元素的化合价为+3; (2)废料含有金属铝、铁及其氧化物,与稀盐酸混合后发生了多个化学反应,在发生的这些反应中,铝、铁与盐酸反应属于氧化还原反应且为置换反应,铝与铁盐反应属于氧化还原反应但不属于四大基本反应类型,则符合反应的离子方程式为Al+3Fe3+=Al3++3Fe2+;(3)由于铝、铁以及氧化铁的物质的量关系无法确定,则不能确定溶液中铁元素的存在形式是否有Fe3+,所得酸性溶液中,不能确定是否一定存在阳离子为Fe3+;欲确认该离子是否存在最常用的试剂名称为硫氰化钾溶液;(4)试剂X必须是氧化剂保证亚铁离子被氧化为铁离子,且不能引入新的杂质,A.Fe为还原剂,不符合; B.HNO3 为氧化剂但反应后会引入杂质硝酸根离子,不符合;C.氯水为氧化剂且反应后不引入新杂质,符合;D.高锰酸钾溶液为氧化剂但反应后会引入杂质,不符合。答案选C;(5)水解形成的聚合物分散在水中的粒子直径在1nm~100nm之间,用简单的实验操作验证该分散系为:用一束光通过混合物,可以看到一条光亮的“通路”,产生丁达尔现象;(6)PAFC中加入过量氢氧化钠溶液反应后生成氢氧化铁沉淀、偏铝酸钠和氯化钠,故操作I的名称为过滤;(7)通入过量的A气体即二氧化碳气体,偏铝酸钠反应生成氢氧化铝和碳酸氢钠,反应的离子方程式为AlO2+CO2+2H2O=Al(OH)3↓+HCO3。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4 , 即可得到I2 , 写出该反应的离子方程式 .
(2)一种碘和氧的化合物(I4O9),可以称为碘酸碘,则I4O9中碘元素的化合价是 .
A.﹣1
B.+1
C.+3
D.+5
(3)若IOH是两性化合物,写出IOH的酸式电离的电离方程式 .
(4)已知反应2HI(g)═H2(g)+I2(g)△H=+11kJmol﹣1 , 1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为kJ.
(5)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g).在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为: .
②上述反应中,正反应速率为υ正=k正x2(HI),逆反应速率为υ逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为(以K和k正表示).
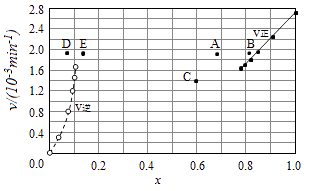
③由上述实验数据计算得到υ正~x(HI)和υ逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母).