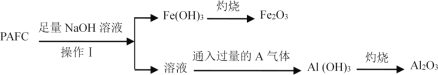题目内容
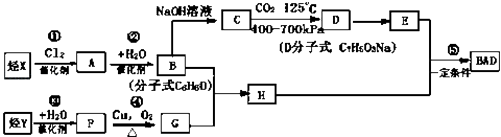
【题目】废弃物回收利用可变废为宝。某工业固体废物的组成为Al2O3、FeO、Fe2O3等。下图是以该固体废物为原料制取氧化铝、磁性Fe3O4胶体粒子的一种工艺流程:

(1)检验制备Fe3O4胶体粒子成功的实验操作名称是____________________________。
(2)写出由溶液B制备磁性Fe3O4胶体粒子的离子方程式__________________________________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2。其原因是____________________________。
(4)向溶液C中加入NaHCO3溶液,溶液的pH_________(填“增大”,“不变”或“减小”)。
(5)固体D是Al(OH)3,空温时Al(OH)3溶于NaOH溶液反应的平衡常数等于20,则此时Al(OH)3![]() A1O2-+H++H2O的电离常数K=_______________。
A1O2-+H++H2O的电离常数K=_______________。
(6)用重路酸钾(K2Cr2O7)可测定产物磁性Fe3O4胶体粒子中铁元素的含量,过程如下图。已知,反应中K2Cr2O7被还原为Cr3+。

①写出甲→乙的化学方程式___________________________________。
②写出乙→丙的离子方程式_________________________________________。
【答案】 丁达尔效应 2Fe3++Fe2++8OH-![]() Fe3O4(胶体)+4H2O N2气氛下,防止Fe2+被氧化 减小 2.0×10-13 SnCl2+2FeCl3=SnCl4+2FeCl2 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
Fe3O4(胶体)+4H2O N2气氛下,防止Fe2+被氧化 减小 2.0×10-13 SnCl2+2FeCl3=SnCl4+2FeCl2 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
【解析】(1) 胶体能够产生丁达尔效应,可以通过丁达尔效应检验制备Fe3O4胶体粒子是否成功。答案为:丁达尔效应
(2)溶液B中含有Fe3+和Fe2+与NaOH溶液在加热的条件下可以制备Fe3O4胶体粒子,制备的离子方程式为:2Fe3++Fe2++8OH-![]() Fe3O4(胶体)+4H2O,答案为:2Fe3++Fe2++8OH-
Fe3O4(胶体)+4H2O,答案为:2Fe3++Fe2++8OH-![]() Fe3O4(胶体)+4H2O
Fe3O4(胶体)+4H2O
(3)Fe2+容易被氧化,持续通入N2,在N2气氛下防止Fe2+被氧化。答案为:N2气氛下,防止Fe2+被氧化。
(4)C为NaAlO2溶液,向NaAlO2溶液中滴加NaHCO3溶液,偏铝酸根离子促进碳酸氢根离子电离且和氢离子结合生成氢氧化铝白色沉淀,方程式为:NaAlO2 + NaHCO3 +H2O=Al(OH)3↓+ Na2CO3,导致溶液的pH减小。答案为:减小
(5)氢氧化铝溶解于氢氧化钠溶液中的离子方程式为:Al(OH)3+OH - AlO2-+2H2O,K=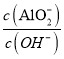 =
= 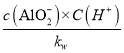 =20, Al(OH)3电离的方程式为:Al(OH)3 AlO2-+H++H2O;由电离方程式可知Ka=c(AlO2-)
=20, Al(OH)3电离的方程式为:Al(OH)3 AlO2-+H++H2O;由电离方程式可知Ka=c(AlO2-)![]() C(H+),由K=
C(H+),由K=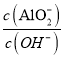 =
= 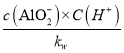 =20和Ka=c(AlO2-)
=20和Ka=c(AlO2-)![]() C(H+)联立可得Ka=K
C(H+)联立可得Ka=K![]() KW=20
KW=20![]() 1
1![]() 10-14= 2.0×10-13,答案为:2.0×10-13
10-14= 2.0×10-13,答案为:2.0×10-13
(6)①Fe3+能把Sn2+氧化为Sn4+,Fe3+被还原为Fe2+,所以甲→乙反应的化学方程式为:SnCl2+2FeCl3=SnCl4+2FeCl2②在酸性条件下K2Cr2O7将Fe2+氧化为Fe3+,还原产物为Cr3+,所以乙→丙的反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O答案为:SnCl2+2FeCl3=SnCl4+2FeCl2、Cr2

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100mL﹣1).
Ⅰ.实验步骤
(1)用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.100 0molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为mL.
(4)滴定.当时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(5)Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
①按实验所得数据,可得c(市售白醋)=molL﹣1(列式计算);市售白醋总酸量=g100mL﹣1(列式计算).
②在本实验的滴定过程中,下列操作会使实验结果偏大的是填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.![]()