题目内容
9. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关 | |
| B. | 由于键能H-R>H-T,故元素R、T对应气态氢化物的沸点:HR>HT | |
| C. | R与Q的电子数相差16 | |
| D. | 最高价氧化物对应的水化物的酸性:X<T<Q |
分析 R单质在暗处与H2剧烈化合并发生爆炸,则R是F元素,由元素R、X、T、Z、Q在元素周期表中的相对位置,可知X是S元素、T是Cl元素、Z是Ar元素、Q是Br元素.
A.HF分子之间存在氢键,存在(HF)n缔合分子;
B.HF分子之间存在氢键,沸点高于HCl,与键能无关;
C.R的原子序数是9、Q的原子序数是35;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:R单质在暗处与H2剧烈化合并发生爆炸,则R是F元素,由元素R、X、T、Z、Q在元素周期表中的相对位置,可知X是S元素、T是Cl元素、Z是Ar元素、Q是Br元素.
A.HF分子之间存在氢键,存在(HF)n缔合分子,相对分子质量实际测量值往往比理论上要大的多,故A正确;
B.HF分子之间存在氢键,沸点高于HCl,与键能无关,故B错误;
C.R的原子序数是9、Q的原子序数是35,则R与Q的电子数的差=35-9=26,故C错误;
D.非金属性T(Cl)>Q(Br)>X(S),元素的非金属性越强,其最高价氧化物的水化物酸性越强,故最高价氧化物对应的水化物的酸性:X<Q<T,故D错误,
故选A.
点评 本题考查结构性质位置关系应用,侧重对元素周期律的考查,正确推断元素是解本题关键,注意理解掌握同主族元素原子序数关系,注意氢键对物质性质的影响,注意F元素没有最高价含氧酸.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
20.下列实验装置和操作能达到实验目的是( )
| A. |  除去CO2中的HCl气体 | B. |  吸收NH3 | ||
| C. |  灼烧海带灰 | D. |  乙醇和水的分离 |
17.氮氧化铝(AlON)是一种透明高硬度防弹材料,可以由反应Al2O3+C+N2=2AlON+CO(高温)合成,下列有关说法正确的是( )
| A. | 氮氧化铝中氮的化合价是-3 | |
| B. | 反应中每生成5.7g AlON的同时生成1.12 L CO | |
| C. | 反应中氮气作氧化剂 | |
| D. | 反应中氧化产物和还原产物的物质的量之比是2:1 |
4.化学与社会生活密切相关,下列说法正确的是( )
| A. | 体积分数为95%的酒精通常作为医用酒精 | |
| B. | 石油的分馏、煤的气化、海水的提镁都包含化学变化 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 利用高纯度硅制造的太阳能电池板可将光能直接转化为电能 |
14.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,并用质谱仪探测到了它存在的证据.下列说法正确的是( )
| A. | 18O是氧元素的一种核素,它的中子数是8 | |
| B. | O4和O2是互为同位素 | |
| C. | 同温同压下,等体积的O4气体和O2含有相同的分子数 | |
| D. | O4转化O2为物理性质 |
1.拟用如图装置制取如下表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热,a、b、c、d表示相应仪器中加入的试剂).能达到实验目的是( )
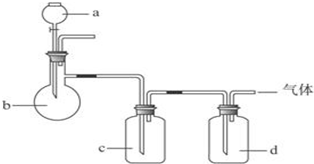

| 选项 | 气体 | a | b | c | d |
| A | SO2 | 硫酸 | 亚硫酸钠 | 浓硫酸 | NaOH溶液 |
| B | NH3 | 浓氨水 | 消石灰 | 浓硫酸 | H2O |
| C | O2 | 双氧水 | MnO2 | H2O | 浓硫酸 |
| D | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
18.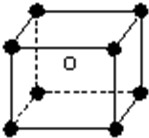 某离子化合物的晶胞如图所示立体结构,阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是( )
某离子化合物的晶胞如图所示立体结构,阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是( )
 某离子化合物的晶胞如图所示立体结构,阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是( )
某离子化合物的晶胞如图所示立体结构,阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是( )| A. | 1:8 | B. | 1:4 | C. | 1:1 | D. | 1:2 |
