题目内容
17.氮氧化铝(AlON)是一种透明高硬度防弹材料,可以由反应Al2O3+C+N2=2AlON+CO(高温)合成,下列有关说法正确的是( )| A. | 氮氧化铝中氮的化合价是-3 | |
| B. | 反应中每生成5.7g AlON的同时生成1.12 L CO | |
| C. | 反应中氮气作氧化剂 | |
| D. | 反应中氧化产物和还原产物的物质的量之比是2:1 |
分析 Al2O3+C+N2$\frac{\underline{\;高温\;}}{\;}$2AlON+CO中,N元素化合价降低,N2为氧化剂,C元素化合价升高,C为还原剂,结合元素化合价的变化判断电子转移的数目.
解答 解:A.由化合价代数和为0可知,氮氧化铝中铝元素化合价为+3价,O为-2价,氮元素的化合价为-1,故A错误;
B.没有说明是标准状况,不能计算生成CO的体积,故B错误;
C.N元素化合价降低,N2为氧化剂,故C正确;
D.CO为氧化产物,AlON为还原产物,由反应可知物质的量比为1:2,故D错误;
故选C.
点评 本题考查氧化还原反应注意把握元素化合价的判断,从化合价变化的角度分析,题目侧重于相关概念的考查,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
17.下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2;
②向Fe(OH)3胶体中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量NaOH溶液;
④向硅酸钠溶液中逐滴加入过量的盐酸.
①向饱和碳酸钠溶液中通入过量的CO2;
②向Fe(OH)3胶体中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量NaOH溶液;
④向硅酸钠溶液中逐滴加入过量的盐酸.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ①③ |
5.X、Y、Z、W四种元素在元素周期表中的相对位置如下图所示,其中X、W的质子数之和为21,由此可知( )
| X | Y | ||
| Z | W |
| A. | X位于元素周期表中第2周期、第VA族 | |
| B. | Y的氢化物(H2Y)不稳定,100℃以上即可分解 | |
| C. | W的非金属性比Y的非金属性弱 | |
| D. | Z的最高价氧化物的水化物是一种强碱 |
12.有关化学反应的方向和速率的研究可以指导化工生产.下列说法正确的是( )
| A. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3△H<0,在任何温度下均为自发反应 | |
| B. | 向新制氯水中加入少量小苏打固体可提高其漂白能力 | |
| C. | 1L密闭容器中发生反应4NH3+5O2?4NO+6H2O,充少量 N2可加快反应速率 | |
| D. | 湿法炼铜的反应为Fe+CuSO4=FeSO4+Cu,反应中的Fe可以用Na代替 |
9. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关 | |
| B. | 由于键能H-R>H-T,故元素R、T对应气态氢化物的沸点:HR>HT | |
| C. | R与Q的电子数相差16 | |
| D. | 最高价氧化物对应的水化物的酸性:X<T<Q |
7.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 饱和氯水中:Na+、K+、Cl-、CO32- | |
| B. | 淀粉溶液中:K+、NH4+、SO42-、I- | |
| C. | Na2SiO3溶液中:Cl-、I-、K+、CO2 | |
| D. | 葡萄糖溶液中:Na+、H+、SO42-、Cr2O72- |
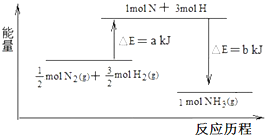 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.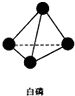 ,并指出1mol白磷(P4)含有P-P键的数目6NA
,并指出1mol白磷(P4)含有P-P键的数目6NA