��Ŀ����
����Ŀ�����÷Ͼ������Ͻ���Ҫ�ɷ�ΪFe��Al��Fe2O3��Al2O3���Ʊ����ײ��ϴ���Fe3O4���Ӽ�������Al���Ʊ�����ͼ��ͼ�� 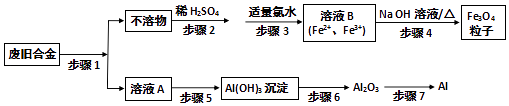
�ش��������⣺
��1������1�����õ��Լ��� �� �漰�Ļ�ѧ��Ӧ������������ԭ��Ӧ�Ļ�ѧ����ʽΪ
��2������3�з�Ӧ�����ӷ���ʽΪ ��
��3������5��ѡ�õ��Լ���������������������ţ��� a��NaOH��Һ b����ˮ c������ d��ͨ�������CO2
��4������7��ÿ��ø�����Al 27g��ת�Ƶĵ�����ĿΪ ��
��5�����й��ڴ���Fe3O4���ӵ�˵����ȷ����������ţ���
A.����Fe3O4���ӻ���������ЧӦ
B.����Fe3O4���ӵĻ�ѧ������ԭ����Fe3O4��ȫ��ͬ
C.����Fe3O4�������ڽ����ɢϵ
D.����Fe3O4����������ֽ��
���𰸡�
��1��NaOH��Һ��2Al+2NaOH+2H2O=2NaAlO2+3H2��
��2��2Fe2++Cl2=2Fe3++2Cl��
��3��d
��4��3NA��1.806��1024
��5��D
���������⣺��1��������֪����1�Ǽ�������������Һ�ܽ�Al��Al2O3 �� ����������ԭ��Ӧ������������������Һ��Ӧ����ƫ�����ƺ���������Ӧ�Ļ�ѧ����ʽΪ��2Al+2NaOH+2H2O=2NaAlO2+3H2�������Դ��ǣ�NaOH��Һ��2Al+2NaOH+2H2O=2NaAlO2+3H2������2������3�з�Ӧ�����ӷ���ʽΪ�������������������������ӣ���Ӧ�����ӷ���ʽΪ��2Fe2++Cl2=2 Fe3++2Cl�� ��
���Դ��ǣ�2Fe2++Cl2=2 Fe3++2Cl������3������5��ѡ�õ��Լ����γ���������������
a��NaOH��Һ��ƫ�����ƣ���a����
b����ˮ��ƫ�����Ʋ���Ӧ������������������������b����
c�������ƫ��������Һ��Ӧ�������ɵ����������������ڹ��������ᣬ������ã���c����
d��ͨ�������CO2 ��ƫ��������Һ��Ӧ��������������������ȫ�����������ӣ���d��ȷ��
���Դ��ǣ�d����4������7�ǵ����������������Ӧ�Ļ�ѧ����ʽΪ��2Al2O3 ![]() 4Al+3O2��������4molAl������ת��12mol������Al 27g���ʵ���=
4Al+3O2��������4molAl������ת��12mol������Al 27g���ʵ���= ![]() =1mol������ת��3mol��Ϊ3NA��1.806��1024 ��
=1mol������ת��3mol��Ϊ3NA��1.806��1024 ��
���Դ��ǣ�3NA ��1.806��1024����5��A������Fe3O4���Ӳ��ǽ��壬��A����
B������Fe3O4���ӵĻ�ѧ������ԭ����Fe3O4��ͬ����B����
C������Fe3O4����Ϊ�����������ڽ����ɢϵ����C����
D������Fe3O4������������������ֽ����D��ȷ��
���Դ��ǣ�D��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��25��ʱ����������ĵ���ƽ�ⳣ�����£�
���� | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ�� | K=1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=1.5��10-2 K2=1.02��10-7 |
��1��CH3COOH��H2CO3��H2SO3��������������������__________(�ѧʽ)��
��2��CH3COOH�ĵ���ƽ�ⳣ������ʽΪK=__________��
��3��д��H2CO3�ĵڶ������뷽��ʽ��_____________��
��4��д��H2SO3��Һ��CH3COONa��Һ��Ӧ�����ӷ���ʽ��____________________��
��5���������Ϊ10mL��pH��Ϊ2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ������pH�ı仯��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��____________(������������ С��������������)����ĵ���ƽ�ⳣ����������__________________��

