题目内容
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是__________________。

【答案】 H2CO3 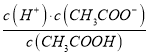 HCO3-
HCO3-![]() CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀释相同的倍数时,HX的pH变化程度更大,则HX酸性更强,电离平衡常数更大
CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀释相同的倍数时,HX的pH变化程度更大,则HX酸性更强,电离平衡常数更大
【解析】本题考查电离平衡常数、电离方程式的书写,(1)电离平衡常数越大,说明电离程度越大,三种酸酸性强弱的顺序是H2SO3>CH3COOH>H2CO3;(2)CH3COOH的电离:CH3COOH![]() CH3COO-+H+,依据电离平衡常数的表达式,即Ka=
CH3COO-+H+,依据电离平衡常数的表达式,即Ka=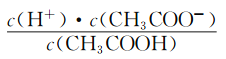 ;(3)碳酸是多元弱酸,其电离应是分步电离,电离方程式为H2CO3
;(3)碳酸是多元弱酸,其电离应是分步电离,电离方程式为H2CO3![]() H++HCO3-、HCO3-
H++HCO3-、HCO3-![]() H++CO32-或是H2CO3+H2O
H++CO32-或是H2CO3+H2O![]() H3O++HCO3-、HCO3-+H2O
H3O++HCO3-、HCO3-+H2O![]() H3O++CO32-,碳酸的第二步电离为:HCO3-
H3O++CO32-,碳酸的第二步电离为:HCO3-![]() H++CO32-或HCO3-+H2O
H++CO32-或HCO3-+H2O![]() H3O++CO32-;(4)根据上述表格数据,电离H+大小顺序是H2SO3>CH3COOH>HSO3-,利用电离平衡常数大的制备电离平衡常数小的,因此H2SO3和CH3COONa发生的离子反应是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的两种酸,稀释相同倍数,酸性强的pH变化大,根据图像,稀释相同倍数,HX的pH变化大,因此HX的酸性强于CH3COOH。
H3O++CO32-;(4)根据上述表格数据,电离H+大小顺序是H2SO3>CH3COOH>HSO3-,利用电离平衡常数大的制备电离平衡常数小的,因此H2SO3和CH3COONa发生的离子反应是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的两种酸,稀释相同倍数,酸性强的pH变化大,根据图像,稀释相同倍数,HX的pH变化大,因此HX的酸性强于CH3COOH。

【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H=a kJ mol-1 。
O2(g) △H=a kJ mol-1 。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
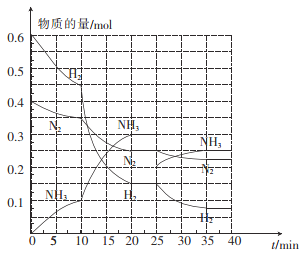
① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)
【题目】某研究性学习小组用浓度为0.20mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。
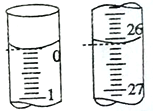
(1)准确量取一定体积的待测液需要使用的仪器是______________。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。
(4)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数 | 待测液体积(mL) | 0.20mol·L-1的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20. 60 |
第一次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为__________。
(5)下列操作会导致测得的待测液的浓度偏大的是________(填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失