题目内容
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
B. 室温下,0.2mol·L-1的Na2SO4溶液中含Na+数目为0.4NA
C. 标准状况下,NA个HF分子所占的体积约为22.4L
D. 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
【答案】A
【解析】
A、根据反应方程式可知铵根中氮元素化合价从-3价升高到0价,生成4molN2转移电子15mol,即生成28gN2即1mol氮气时转移电子的物质的量为1mol×15/4=3.75mol,故A正确;
B、溶液体积未知,不能计算0.2mol·L-1的Na2SO4溶液中含Na+数目,故B错误;
C、标准状况下HF不是气态,NA个HF分子所占的体积不是22.4L,故C错误;
D、根据反应方程式3Fe+4H2O(g)![]() Fe3O4+4H2可知,消耗0.2mol铁时,生成氢气的物质的量为0.8/3 mol,故D错误。
Fe3O4+4H2可知,消耗0.2mol铁时,生成氢气的物质的量为0.8/3 mol,故D错误。
答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】某同学进行下列实验:
操作 | 现象 |
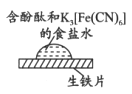
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水
| 放置一段时间后,生铁片上出现如图所示“斑痕”。边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈
|
下列对实验现象解释不正确的是
A. 中心区为蓝色的原因是铁失电子被氧化,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀
B. 边缘处为红色的原因是发生吸氧腐蚀,生成了OH-,使溶液中c(OH-)>c(H+)
C. 边缘处为红色的原因是发生析氢腐蚀,消耗了H+,打破了水的电离平衡,使c(OH-)>c(H+)
D. 交界处出现铁锈的原因是4Fe2++8OH-+O2+2H2O=4Fe(OH)3,Fe(OH)3分解得到铁锈