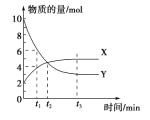
题目内容
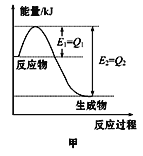
【题目】已知H2(g)+1/2O2(g)=H2O(g)
反应过程中能量变化如下图:
回答下列问题:
(1)图中a,b分别代表什么意义?
a_______________,b______________________。
(2)该反应是____反应(填“吸热”或“放热”),△H____(填“<0”或“>0”)。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+![]() O2(g)═H2O(l) ΔH3=-285.8kJ/mol
O2(g)═H2O(l) ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式__________________。
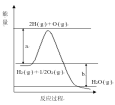
(4)图甲是一定的温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):___________。
(5)科学家寻找高效催化剂实现大气污染物转化:2CO(g)+2NO(g)N2(g)+2CO2(g)△H1
已知:CO的燃烧热△H2=-283kJ·moL-1。几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | N |
键能/kJ·moL-1 | 945 | 498 | 630 |
N2(g)+O2(g)=2NO(g)△H3=____________,上述反应的△H1=_____________。
【答案】活化能 反应热 放热 < 2C(s)+2H2(g)+O2(g)=CH3COOH(l) ![]() = -488.3kJ/mol N2(g)+3H2(g)=2NH3(g)
= -488.3kJ/mol N2(g)+3H2(g)=2NH3(g) ![]() =2(Q1-Q2) kJ/mol +183 kJ/mol -749 kJ/mol
=2(Q1-Q2) kJ/mol +183 kJ/mol -749 kJ/mol
【解析】
(1) 分子变成原子时吸收的能量,为正反应的活化能;生成物的总能量与反应物的总能量的差值是该反应的反应热。
(2)最终放热还是吸热取决于反应物和生成物的能量哪个更高,若反应物能量更高,则是放热反应。
(3)已知几个反应的反应热,求另外一个反应的反应热,可利用盖斯定律求解。
(4)可利用图像数据求出生成物与反应物的能量差,即反应热。
(5)求解反应热的常见方法有两种,一是盖斯定律,一是键能。已知几个反应的反应热,求另外一个反应的反应热,就用盖斯定律,已知反应物和生成物的键能,就用键能求反应热。
(1) 分子变成原子时,断键要吸收能量,所以a代表正反应的活化能;生成物的总能量与反应物的总能量的差值是该反应的反应热,所以b代表反应热。
(2)因为生成物能量更低,所以能量减少,所以是放热反应,△H<0;
(3)根据盖斯定律求解,反应2C(s)+2H2(g)+O2(g)═CH3COOH(l),其![]() =870.3kJ/mol+2×(-393.5kJ/mol)+(-571.6kJ/mol)=-488.3 kJ/mol。
=870.3kJ/mol+2×(-393.5kJ/mol)+(-571.6kJ/mol)=-488.3 kJ/mol。
(4)根据图可知,反应物的总能量比生成物的总能量高,该反应为放热反应,即生成1molNH3(g)时放出的热量为(Q2-Q1)kJ,所以工业合成氨的热化学方程式为N2(g)+3H2(g)=2NH3(g) ![]() =2(Q1-Q2) kJ/mol
=2(Q1-Q2) kJ/mol
(5) 焓变=反应物键能总和-生成物键能总和,则反应N2(g)+O2(g)=2NO(g)![]() =945kJ/mol+498kJ/mol-630kJ/mol×2=+183 kJ/mol ③,CO的燃烧热为-283kJ kJ/mol,即2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol ②,②-③得到2CO(g)+2NO(g)
=945kJ/mol+498kJ/mol-630kJ/mol×2=+183 kJ/mol ③,CO的燃烧热为-283kJ kJ/mol,即2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol ②,②-③得到2CO(g)+2NO(g)![]() N2(g)+2CO2(g),所以2CO(g)+2NO(g)
N2(g)+2CO2(g),所以2CO(g)+2NO(g)![]() N2(g)+2CO2(g),△H1=-566kJ/mol-183 kJ/mol =-749 kJ/mol。
N2(g)+2CO2(g),△H1=-566kJ/mol-183 kJ/mol =-749 kJ/mol。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案