题目内容
【题目】下列说法中正确的是( )
A.标准状况下,将22.4 LHCl溶于1 L水,可配成1 mol/L的稀盐酸
B.把200 mL3 mol/L的MgCl2溶液跟100 mL3 mol/L的KCl溶液混合后,溶液中的Cl-的物质的量浓度仍然是3 mol/L
C.用胆矾(CuSO45H2O)配制500 mL5 mol/L的CuSO4溶液,需胆矾40 g
D.将0.1 mol NaCl配成100 mL溶液,从中取出10 mL,所取出溶液的物质的量浓度为1 mol/L
【答案】D
【解析】
A. 标准状况下,22.4LHCl的物质的量是1 mol,溶于1L水,不能确定溶液的体积,因此不能计算配成的稀盐酸的浓度,A错误;
B. 混合溶液中Cl-的浓度为c(Cl-)=![]() =5 mol/L,B错误;
=5 mol/L,B错误;
C. 配制500 mL5 mol/L的CuSO4溶液,需要溶质的物质的量n(CuSO4)= 5 mol/L×0.5 L=2.5 mol,根据Cu元素守恒,可知需胆矾质量为m(CuSO45H2O)= 2.5 mol×250 g/mol=625 g,C错误;
D. 溶液具有均一性,溶液各处的浓度相同,与取出的溶液的体积大小无关,所以将0.1molNaCl配成100mL溶液,溶液的浓度c(NaCl)=0.1 mol÷0.1 L=1 mol/L,从中取出10mL,所取出溶液的物质的量浓度为1 mol/L,D正确;
故合理选项是D。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】已知H2(g)+1/2O2(g)=H2O(g)
反应过程中能量变化如下图:
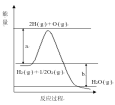
回答下列问题:
(1)图中a,b分别代表什么意义?
a_______________,b______________________。
(2)该反应是____反应(填“吸热”或“放热”),△H____(填“<0”或“>0”)。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+![]() O2(g)═H2O(l) ΔH3=-285.8kJ/mol
O2(g)═H2O(l) ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式__________________。
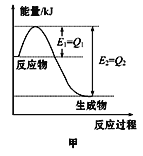
(4)图甲是一定的温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):___________。
(5)科学家寻找高效催化剂实现大气污染物转化:2CO(g)+2NO(g)N2(g)+2CO2(g)△H1
已知:CO的燃烧热△H2=-283kJ·moL-1。几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | N |
键能/kJ·moL-1 | 945 | 498 | 630 |
N2(g)+O2(g)=2NO(g)△H3=____________,上述反应的△H1=_____________。