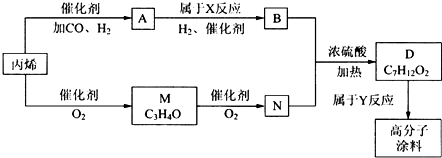
题目内容
12.(1)位于第4周期元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子排布为3d84s2,Q2+的未成对电子数是4.(2)Fe、Mn两元素的部分电离能数据列于下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
分析 (1)位于第4周期元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,再结合核外电子排布规律解答;
(2)根据锰、铁原子核外电子排布结合轨道处于半满、全满、全空时能量更低稳定分析.
解答 解:(1)位于第4周期元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Ni元素是28号元素,Ni原子价电子排布式为3d84s2,Fe2+的核外电子排布式为1s24s22p63s23d6,3d能级有4个单电子,
故答案为:3d84s2;4;
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,其基态原子核外电子排布式为[Ar]3d54s2,Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;铁原子序数是26,核外电子数为26,该元素原子的电子排布式为1s22s22p63s23p63d64s2,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
点评 本题考查元素周期表、核外电子排布、电离能大小比较,根据“周期表中既处于同一周期又位于同一族”确定元素是关键,题目难度中等.

练习册系列答案
相关题目
2.下列反应不属于氧化还原反应的是( )
| A. | 碳酸氢钠受热分解 | B. | 铝和三氧化二铁高温下反应 | ||
| C. | 过氧化钠与水反应 | D. | 铜和浓硫酸反应 |
3.对于反应:TiCl4+4Na═4NaCl+Ti,下列说法正确的是( )
| A. | 该反应说明钠是强还原剂,可用于冶炼金属 | |
| B. | 该反应条件是TiCl4在熔融状态或水溶液中 | |
| C. | Ti是氧化产物 | |
| D. | TiCl4是还原剂 |
20.下列物质中能抑制水的电离且使溶液呈现出酸性的是( )
| A. | Na2CO3 | B. | NaOH | C. | K2SO4 | D. | H2SO4 |
7.C、N、S都是重要的非金属元素,下列说法正确的是( )
| A. | 三种元素在自然界中都只以化合态存在 | |
| B. | 三种元素的单质在化学反应中都只作氧化剂 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 三种元素的氢化物(CH4、NH3、H2S)都易溶于水 |
4.关于如图所示装置的叙述,正确的是( )
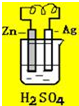

| A. | 银是负极,银片上有气泡产生 | B. | 锌片质量逐渐减少,银片质量不变 | ||
| C. | 电流从锌片经导线流向银片 | D. | 氢离子在锌片上被还原 |
1.某温度下,在体积固定不变的密闭容器中进行如下可逆反应:X(g)+Y(g)?Z(g)+W(s)△H>0,下列叙述不正确的是( )
| A. | 当容器中气体压强不变时,反应达到平衡 | |
| B. | 升高温度,平衡正向移动 | |
| C. | 加入少量W,逆反应速率增大 | |
| D. | 当气体密度不变时,说明反应达到平衡 |
2.下列方法可使海水转化为饮用水的是( )
| A. | 过滤 | B. | 蒸馏 | C. | 活性炭吸附 | D. | 静置沉淀 |