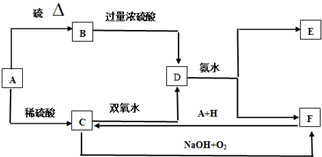
题目内容
4.关于如图所示装置的叙述,正确的是( )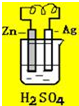
| A. | 银是负极,银片上有气泡产生 | B. | 锌片质量逐渐减少,银片质量不变 | ||
| C. | 电流从锌片经导线流向银片 | D. | 氢离子在锌片上被还原 |
分析 由图可知,为Ag、Zn原电池,发生Zn+H2SO4═ZnSO4+H2↑,Zn为负极,电流从正极流向负极,以此来解答.
解答 解:由图可知,为Ag、Zn原电池,发生Zn+H2SO4═ZnSO4+H2↑,
A.Ag为正极,表面有气泡产生,故A错误;
B.Zn为负极,锌片质量逐渐减少,Ag为正极,银片质量不变,故B正确;
C.Ag为正极,则电流从银片经导线流向锌片,故C错误;
D.该反应生成氢气,是因氢离子在银片表面被还原,故D错误;
故选B.
点评 本题考查原电池,明确原电池反应及工作原理即可解答,注意该电池中活泼金属作负极,题目较简单.

练习册系列答案
相关题目
14.下列有关化学基本概念与划分依据的联系正确的是( )
| A. | 氧化还原反应与非氧化还原反应:反应前后元素化合价是否变化 | |
| B. | 纯净物与混合物:是否仅含有一种元素 | |
| C. | 强电解质与弱电解质:溶液的导电能力大小 | |
| D. | 溶液与胶体:能否发生丁达尔效应 |
12.(1)位于第4周期元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子排布为3d84s2,Q2+的未成对电子数是4.
(2)Fe、Mn两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
(2)Fe、Mn两元素的部分电离能数据列于下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
9.有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断不正确的是( )
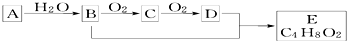

| A. | 鉴别A和甲烷可选择酸性高锰酸钾溶液 | |
| B. | B、D均能与金属钠反应 | |
| C. | 物质C的结构简式为CH3CHO | |
| D. | B+D→E的化学方程式为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5 |
16.钾和钠化学性质相似,能最好地解释这个事实的是( )
| A. | 它们的最外层电子数相同 | B. | 它们的原子半径相差不大 | ||
| C. | 它们都是金属元素 | D. | 它们的最高化合价相同 |
13.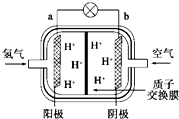 为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
 为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )| A. | 工作时,“阳极”周围溶液的酸性增强 | |
| B. | 氢气在电极上发生还原反应 | |
| C. | 图中标出的“阴极”实际是原电池的负极 | |
| D. | 工作过程中,质子(H+)从“阴极”一边透过质子交换膜移动到“阳极”一边与OH-反应生成水 |
14.0.5L 1mol/L FeCl3溶液与3L 0.5mol/L KCl溶液中的Cl-的数目之比( )
| A. | 1:6 | B. | 1:1 | C. | 2:1 | D. | 3:1 |