题目内容
6.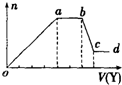 某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.| 阴离子 | CO32-、Si32-、AlO2-、Cl- |
| 氧离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(2)若Y是NaOH溶液,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,则oa段转化为沉淀的离子是Al3+、Mg2+,ab段反应的离子方程式为NH4++OH-═MH3•H2O.bc段反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
分析 溶液无色说明溶液中不含Fe3+;
(1)如果Y是盐酸,向溶液中加盐酸,先生成沉淀,则溶液中可能含SiO32-、AlO2-或两者中的一种,即生成的沉淀为H2SiO3、Al(OH)3或两者中的一种,则溶液中不含Al3+、Mg2+;当a-b段时,沉淀的量不变化,发生的是盐酸和碳酸根离子反应生成气体;当b-c段时沉淀的质量减少,即部分沉淀和盐酸反应,部分沉淀和盐酸不反应,说明生成的沉淀既有H2SiO3又有Al(OH)3,原溶液中有硅酸根离子和偏铝酸根离子,弱酸根离子和铵根离子能双水解,所以溶液中不含NH4+,含有的阳离子是Na+;
(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,当a-b段时,沉淀的量不变化,氢氧化钠和铵根离子反应生成气体;当b-c段时沉淀的质量减少,部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有铝根离子和镁离子,则溶液中不含硅酸根离子、碳酸根离子和偏铝酸根离子,所以溶液中含有的阴离子是氯离子.
解答 解:溶液无色说明溶液中不含Fe3+;
(1)如果Y是盐酸,向溶液中加盐酸,先生成沉淀,则溶液中可能含SiO32-、AlO2-或两者中的一种,即生成的沉淀为H2SiO3、Al(OH)3或两者中的一种,则溶液中不含Al3+、Mg2+;当a-b段时,沉淀的量不变化,发生的是盐酸和碳酸根离子反应生成气体:CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑;当b-c段时沉淀的质量减少,即部分沉淀和盐酸反应:Al(OH)3+3H+═Al3++3H2O,部分沉淀和盐酸不反应,说明生成的沉淀既有H2SiO3又有Al(OH)3,原溶液中有SiO32-和AlO2-,则oa段发生反应的离子方程式SiO32-+2H+═H2SiO3↓,AlO2-+H++H2O═Al(OH)3↓,由于SiO32-和AlO2-和铵根离子能双水解,所以溶液中不含NH4+,含有的阳离子是Na+.
则X中一定含有的离子是CO32-、SiO32-、AlO2-、Na+,oa段发生反应的离子方程式SiO32-+2H+═H2SiO3↓,AlO2-+H++H2O═Al(OH)3↓,ab段发生反应的离子方程式CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,bc段发生反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
故答案为:CO32-、SiO32-、AlO2-、Na+;SiO32-+2H+═H2SiO3↓、AlO2-+H++H2O═Al(OH)3↓;CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑;Al(OH)3+3H+═Al3++3H2O;
(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,溶液中可能含Al3+、Mg2+或两者中的一种,由于弱碱阳离子和弱酸根会双水解而不能共存,即溶液中不含CO32-、SiO32-、AlO2-,由于溶液一定要保持电中性,故溶液中一定含Cl-;当a-b段时,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH4++OH-═MH3•H2O,即溶液中含NH4+;当b-c段时沉淀的质量减少但没有完全溶解,即部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有Al3+、Mg2+,即bc段的反应为:Al(OH)3+OH-═AlO2-+2H2O.
即则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-;由于溶液中有Al3+、Mg2+,故oa段转化为沉淀的离子是Al3+、Mg2+,ab段是氢氧化钠和铵根离子反应生成气体,反应的离子方程式为NH4++OH-═MH3•H2O;溶液中有Al3+、Mg2+,即沉淀中含Al(OH)3和Mg(OH)2,故bc段的反应为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3+、Mg2+、NH4+、Cl-;Al3+、Mg2+;NH4++OH-═MH3•H2O;Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查了溶液中离子的判断,能明确离子的性质是解本题的关键,会根据图象确定溶液中存在的离子及其含量,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 光照甲烷与氯气的混合物;乙烯使酸性高锰酸 钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯滴人浓硝酸和浓硫酸的混合液中水浴加热; 乙烯与水蒸气在一定条件下反应生成乙醇 | |
| D. | 在苯中滴人溴水,溴水褪色;乙烯使溴水褪色. |
 (a、b、c均大于零)下列说法不正确的是( )
(a、b、c均大于零)下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a) kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ |
(1)Fe$\stackrel{H_{2}SO_{4}}{→}$H2$\stackrel{CuO}{→}$Cu
(2)CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu.
| A. | 消耗氧化铜的质量不同 | B. | 消耗铁的质量相同 | ||
| C. | 消耗硫酸的质量相同 | D. | 生成硫酸亚铁的质量不同 |
| A. | 高温、低压 | B. | 低温、高压 | C. | 低温、低压 | D. | 高温、高压 |
| A. | 含有1mol Na2SO4的溶液中,含有的Na+个数为NA | |
| B. | 18g水中含有电子数为8NA | |
| C. | 标准状况下,22.4LH2含有氢原子个数为2NA | |
| D. | 1.2L H2一定含有NA个氢原子 |