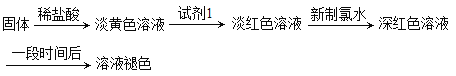
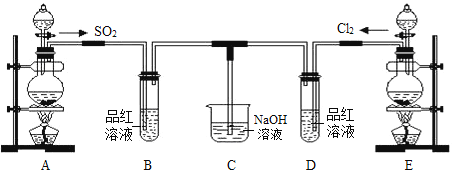
题目内容
【题目】有人设想以N2和H2为反应物,以溶有X的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示。下列说法正确的是
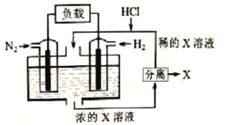
A. 放电时H+向左移动,生成的物质X是NH4Cl
B. 通入H2的一极为正极
C. 通入N2的电极反应为:N2+6H+-6e-=2NH3
D. 放电过程右边区域溶液pH逐渐增大
【答案】A
【解析】以N2、H2为原料,以溶有X的稀盐酸为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,电极方程式为H2-2e-=2H+,总反应为:N2+ 3H2+2HCl=2NH4Cl。A. 放电时H+向正极移动,即向左移动,生成的物质X是NH4Cl,故A正确;B. 通入H2的一极为负极,故B错误;C. 通入N2的电极为正极,发生还原反应,N2+6e-+8H+=2NH4+,故C错误;D. 放电过程右边区域为负极区,H2-2e-=2H+,溶液pH逐渐减小,故D错误;故选A。

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目