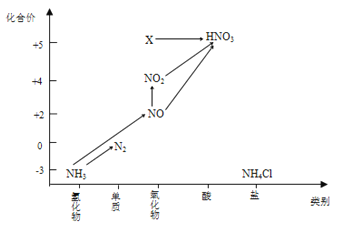
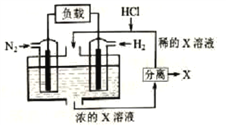
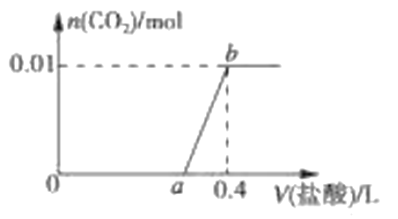
题目内容
【题目】化学计量在化学中占有重要地位。请回答下列问题:
(1)0.3 mol NH3分子中所含原子数与约__________个H2O分子中所含原子数相等。
(2)V mL含a g Al3+的Al2(SO4)3溶液中所含SO42的物质的量浓度为_____ mol·L1。
(3)在一定温度和压强下,1体积气体X2与3体积Y2化合生成2体积气态化合物,该化合物的化学式为_________。
(4)将各0.3 mol的钠、镁、铝分别放入100 mL 1 mol·L1的盐酸中,同温同压下产生气体的体积比为_____________。
(5)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,当生成1 mol硝酸锌时,参加反应的硝酸的物质的量为_________ mol。
【答案】2.408×1023 500a∕9V XY3或Y3X 3:1:1 2.5
【解析】
(1)先求出氨气分子中原子的物质的量,在根据NH3与H2O中原子个数相同求出水分子的物质的量,在乘以阿伏伽德罗常数即得结果;
(2)先求出铝离子的物质的量,再根据与硫酸根离子的个数比2:3求出硫酸根离子的物质的量,在除以溶液体积即得SO42的物质的量浓度;
(3)根据质量守恒定律计算;
(4)将三种金属各0.3mol分别投入100mL 1mol/L的盐酸中,可知三种金属都过量,应按盐酸的量计算,镁、铝产生氢气物质的量相等,产生氢气的物质的量为:(0.1L×1mol/L)×1/2=0.05 mol,但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,钠与水反应产生氢气应按钠的物质的量计算:0.3mol钠产生0.15mol氢气;
(5)硝酸具有氧化性,可以将金属氧化到最高价,被还原的硝酸生成硝酸铵,据此结合方程式来计算回答。
(1)0.3mol NH3分子中含有的原子的物质的量为0.3mol×4=1.2mol,则n(H2O)=![]() =0.4mol,二者含有的原子个数相等,N(H2O)=0.4mol×6.02×1023/mol=2.408×1023;
=0.4mol,二者含有的原子个数相等,N(H2O)=0.4mol×6.02×1023/mol=2.408×1023;
正确答案:2.408×1023
(2)SO42的物质的量浓度为![]() mol·L1。
mol·L1。
正确答案: 500a∕9V;
(3)设生成的气体的化学式为A,同温同压下,气体的体积之比等于物质的量之比,1体积X2(气)和3体积Y2(气)化合生成2体积气态化合物,则反应方程式为X2+3Y2=2A,根据原子守恒,所以A为XY3或Y3X;
正确答案:XY3或Y3X;
(4)将三种金属各0.3mol分别投入100mL 1mol/L的盐酸中,可知三种金属都过量,应按盐酸的量计算,镁、铝产生氢气物质的量相等,产生氢气的物质的量为:(0.1L×1mol/L)×1/2=0.05 mol,但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,钠与水反应产生氢气应按钠的物质的量计算:0.3mol钠产生0.15mol氢气。故将钠、镁、铝各0.3mol 分别放入100mL 1mol/L的盐酸中,产生氢气的物质的量之比为:0.15mol:0.05mol:0.05mol=3:1:1,所以同温同压下产生的气体体积比是3:1:1;
正确答案:3:1:1。
(5)反应的方程式可以表达为:4Zn+10HNO3(稀)=4Zn(NO3)2+NH4NO3+5H2O,生成1mol的硝酸锌,参加反应的硝酸10/4=2.5mol
正确答案:2.5。