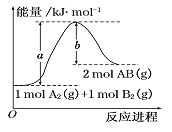
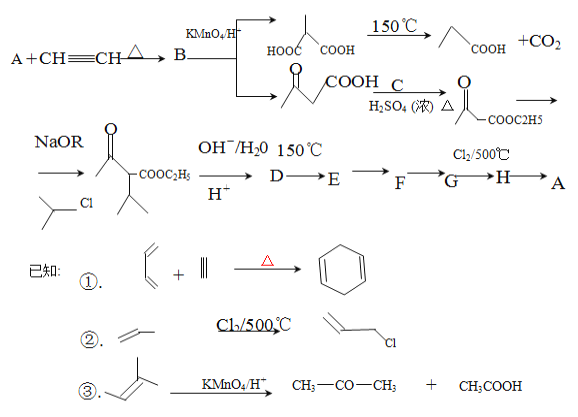
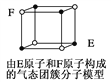
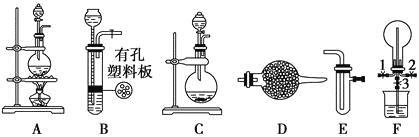
题目内容
【题目】含有amol FeBr2的溶液中,通入xmol Cl2.下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A. x=0.4a,2Fe2++Cl2=2Fe3++2Cl﹣
B. x=a,2Fe2++2Br﹣+2Cl2=Br2+2Fe3++4Cl﹣
C. x=0.6a,2Br﹣+Cl2=Br2+2Cl﹣
D. x=1.5a,2Fe2++4Br﹣+3Cl2=2Br2+2Fe3++6Cl﹣
【答案】C
【解析】
由于还原性:Fe2+>Br-,通入Cl2,依次发生2Fe2++Cl2=2Fe3++2Cl-,2Br-+Cl2=Br2+2Cl-,
当n(Cl2):n(FeBr2)≤![]() 时,只氧化Fe2+,当n(Cl2):n(FeBr2)≥
时,只氧化Fe2+,当n(Cl2):n(FeBr2)≥![]() 时,Fe2+和Br-被完全氧化,介于二者之间时,Fe2+被完全氧化,Br-被部分氧化,据此分析可得结论。
时,Fe2+和Br-被完全氧化,介于二者之间时,Fe2+被完全氧化,Br-被部分氧化,据此分析可得结论。
A.x=0.4a,n(Cl2):n(FeBr2)=0.4<![]() ,只氧化Fe2+,故A正确;
,只氧化Fe2+,故A正确;
B.x=a,n(Cl2):n(FeBr2)介于![]() ~
~![]() ,Fe2+被完全氧化,amolFe2+被氧化消耗0.5amolCl2,剩余0.5amolCl2可与amolBr-发生氧化还原反应,则反应的离子方程式为2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-,故B正确;
,Fe2+被完全氧化,amolFe2+被氧化消耗0.5amolCl2,剩余0.5amolCl2可与amolBr-发生氧化还原反应,则反应的离子方程式为2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-,故B正确;
C.x=0.6a,n(Cl2):n(FeBr2)介于![]() ~
~![]() ,Fe2+被完全氧化,Br-被部分氧化,故C错误;
,Fe2+被完全氧化,Br-被部分氧化,故C错误;
D.x=1.5a,Fe2+和Br-恰好被完全氧化,反应的离子方程式为2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-,故D正确.
答案选B。

【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
4 | ⑧ | ⑨ | ⑩ |
(1)写出下列元素的元素符号:① _____ ②_____ ⑩_____
(2)在这些元素中,最活泼的金属元素是_____,最不活泼的元素是_____。
(3)这些元素的最高价氧化物对应水化物中,具有两性的是__________,它在水中的电离方程式为______________________________________________/span>
(4)将元素⑤、⑨和⑩的简单离子按半径由大到小排序____________________
(5)在③与④的单质中,化学性质较活泼的是____,写出一个可以验证该结论的化学事实______________________________________________________________