题目内容
【题目】根据图的能量图,下列说法正确的是:
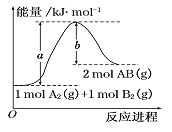
A. A2(g) + B2(g) = 2AB(g) 是一个放热反应
B. 2molAB的总能量大于1molA2和lmolB2的能量之和
C. 2AB(g) = A2(l) + B2(l) △H<(b-a)kJ/mo1
D. 1molA2(g)和1molB2(g)的能量之和为akJ
【答案】C
【解析】
由图可知,反应物总能量小于生成物总能量,为吸热反应,△H>0,且焓变等于正逆反应的活化能之差,互为逆反应时焓变的数值相同、符号相反,据此分析解答。
A.由图可知,反应物总能量小于生成物总能量,则A2(g)+B2(g)=2AB(g)是吸热反应,故A错误;
B.由图可知,2 mol AB(g)的总能量大于1 mol A2(g)和 1 mol B2(g)的能量之和,物质能量与物质状态有关,未注明物质的状态,无法判断2molAB的总能量与1molA2和lmolB2的能量之和的大小关系,故B错误;
C.由图可知A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol,互为逆反应时焓变的数值相同、符号相反,则2AB(g)=A2(g)+B2(g))△H=(b-a) kJ/mol,因生成物中气态能量比液态能量高,生成液态生成物放热更多,则2AB(g)=A2(l)+B2(l)△H<(b-a) kJ/mol,故C正确;
D.a为正反应的活化能的数值,由图不能确定反应物的总能量,故D错误;
答案选C。

练习册系列答案
相关题目



