题目内容
【题目】下列说法错误的是( )
A. 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B. 1mol碳化硅晶体中,平均含有4mol C—Si共价键
C. 水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
D. 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE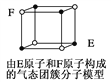
【答案】D
【解析】A.根据中心原子形成的价层电子对数判断;B.利用均摊法判断;C.氢键的作用力大于普通分子间作用力;D.团簇分子中含有4个E原子和4个F原子。
A. PH4+、PO43-中都形成4个σ键且孤电子对数均为0,则二者均为正四面体结构,故A正确;
B.碳化硅晶体中,每个C原子与4个Si原子形成共价键,则1mol碳化硅晶体中,平均含有4mol C—Si共价键,故B正确;
C.氢键的作用力大于普通分子间作用力,H2O分子间存在氢键,H2S分子间不能形成氢键,导致水的沸点比硫化氢的高,故C正确;
D.团簇分子中含有4个E原子和4个F原子,分子式应为E4F4或F4E4,故D错误;答案选D。

练习册系列答案
相关题目
