题目内容
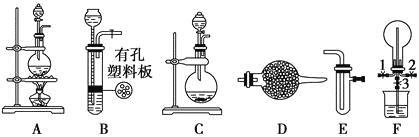
【题目】有下列装置图
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与____________(填装置编号)连接;装置C中的烧瓶内固体宜选用________________________。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.浓硫酸
(2)装置A、E、E连接可制取纯净、干燥的氯气,A中发生的离子反应方程式为:_________________;则两个E装置内的药品依次是_________、_____________。
Ⅱ.探究某些物质的性质
(3)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象_______________。
(4)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式_________________。
(5)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为________________;F的烧杯所起的作用是_______________________________。
【答案】D a MnO2 + 4H+ + 2Cl- =加热= Mn2+ + Cl2↑+ 2H2O 饱和食盐水 浓硫酸 装置E中的NaBr溶液变橙红 CH2=CH2+Br2―→Br—CH2—CH2—Br SO2+2H2S=3S↓+2H2O 吸收尾气
【解析】
(1)浓氨水与生石灰不需要加热产生氨气,要制取氨气应连接盛有碱石灰的干燥管干燥氨气;
(2)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,浓盐酸易挥发,生成的氯气中含有氯化氢和水蒸气,用饱和食盐水除去氯气中的氯化氢,用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气;
(3)氯气的氧化性强于溴,能够置换溴,溴水为橙红色;
(4)乙烯含有碳碳双键能够与溴发生加成反应;
(5)二氧化硫具有弱的氧化性能够氧化硫化氢生成留单质;二氧化硫、硫化氢都有毒,应进行尾气处理。
(1)C装置是不需要加热制备氨气的装置,浓氨水以挥发,滴入生石灰即可产生氨气,制取干燥氨气可以用碱石灰干燥氨气;为制取干燥氨气,可将装置C连接D的干燥氨气的装置,装置C中的烧瓶内固体宜选用碱石灰;
故答案为:D;a。
(2)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,离子方程式为:MnO2 +4H++2Cl-
MnCl2+Cl2↑+2H2O,离子方程式为:MnO2 +4H++2Cl-![]() Mn2++Cl2↑+2H2O,浓盐酸易挥发,生成的氯气中含有氯化氢和水蒸气,用饱和食盐水除去氯气中的氯化氢,用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气,故答案为:MnO2 +4H++2Cl-
Mn2++Cl2↑+2H2O,浓盐酸易挥发,生成的氯气中含有氯化氢和水蒸气,用饱和食盐水除去氯气中的氯化氢,用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气,故答案为:MnO2 +4H++2Cl-![]() Mn2++Cl2↑+2H2O,饱和食盐水,浓硫酸。
Mn2++Cl2↑+2H2O,饱和食盐水,浓硫酸。
(3)装置A为制取氯气的装置,制取的氯气通入到盛有溴离子的盐溶液中,氯气与溴离子发生氧化还原反应生成溴单质,溴单质溶液水形成橙红色溶液;
故答案为:装置E中的NaBr溶液变橙红色。
(4)乙烯含有碳碳双键能够与溴发生加成反应,反应方程式:CH2=CH2+Br2→Br-CH2-CH2-Br;故答案为:CH2=CH2+Br2→Br-CH2-CH2-Br。
(5)二氧化硫氧化硫化氢生成硫单质,2H2S+SO2=3S↓+2H2O;F烧杯是吸收剩余气体二氧化硫或硫化氢有毒气体的作用;故答案为:SO2+2H2S=3S↓+2H2O;吸收尾气。