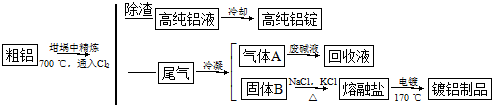
题目内容
4.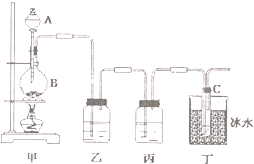 某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:
某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:(1)烧瓶B中盛MnO2,大试管C中盛NaOH溶液.
(2)烧瓶B中发生反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;试管C中发生反应的离子方程式Cl2+2OH-═Cl-+ClO-+H2O.
(3)有同学认为可以省去某些装置,你认为怎样?
①能否省去乙装置不能(答“能”或“不能”),理由是会降低NaClO的含量;
②能否省去丙装置能(答“能”或“不能”),理由是NaOH溶液中含有水.
分析 本实验目的是制备次氯酸钠,根据实验装置可知,首先制备氯气,甲装置中发生反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,因氯化氢易挥发,所以制得的氯气中含有氯化氢、水,HCl气体进入丁装置中,消耗NaOH,降低NaClO的含量,所以通过B装置将氯气中的HCl除去,装置丙:除去氯气中的水蒸气.要提高次氯酸钠的含量,根据题意可知应在较低温度下反应,否则如温度过高则易生成NaClO3,丁装置中:冰水的作用防止Cl2与NaOH溶液在温度较高时,发生其他反应,低温下氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,制得次氯酸钠.
(1)依据图中仪器特点结合反应流程分析,烧瓶B中盛MnO2,大试管C中盛NaOH溶液;
(2)烧瓶B中二氧化锰和浓盐酸发生氧化还原反应生成氯化锰、氯气和水,试管C中氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(3)①氯化氢不除,氯化氢和氢氧化钠反应生成氯化钠和水会消耗NaOH,降低NaClO的含量;②氯气与氢氧化钠反应在溶液中进行,无需用丙装置除去氯气中的水.
解答 解:甲装置中发生反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,乙装置中:用饱和的氯化钠溶液除去氯气中的氯化氢,装置丙中:用浓硫酸除去氯气中的水蒸气,丁装置中:冰水的作用防止Cl2与NaOH溶液在温度较高时,发生其他反应,试管C中氯气和氢氧化钠反应:Cl2+2NaOH═NaCl+NaClO+H2O.
(1)根据实验装置可知,首先制备氯气,发生反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,则A中盛放浓盐酸,B中盛放MnO2,氯气和NaOH反应生成次氯酸钠,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,氯气经除杂后在C中和NaOH反应生成次氯酸钠,
故答案为:MnO2;NaOH溶液;
(2)烧瓶B中二氧化锰和浓盐酸发生氧化还原反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,试管C中氯气和氢氧化钠反应:Cl2+2NaOH═NaCl+NaClO+H2O,其离子反应为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;Cl2+2OH-═Cl-+ClO-+H2O;
(3)①乙装置不能省略,可用来除去HCl,否则氯化氢和氢氧化钠反应生成氯化钠和水会消耗NaOH,降低NaClO的含量,
故答案为:不能;会降低NaClO的含量;
②氯气与氢氧化钠溶液反应生成次氯酸钠,反应在溶液中进行,则没有必要除去氯气中的水蒸气,故答案为:能;NaOH溶液中含有水.
点评 本题考查氯气的实验室制法和氯气的化学性质,题目难度中等,注意把握实验的目的和反应原理,此为解答实验题的关键,注意题中图示信息.

(1)增加水的量或升高温度,一定可以加快镁跟水的反应速率
(2)增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(3)对于反应CaCO3(s)?CaO(s)+CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对于反应3H2(g)+N2(g)?2NH3(g),在密闭容器中进行(固定体积),现充入氦气,由于容器中压强增大,则化学反应速率加快
(5)对于反应3H2(g)+N2(g)?2NH3(g),使用适合催化剂,正逆反应速率同等程度加快.
| A. | (1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | (5) |
| A. | NH4Cl是电解质,所以NH4Cl在溶液通电时可以电离 | |
| B. | Al(OH)3是两性氢氧化物,所以不能用过量的氨水与铝盐制备 | |
| C. | 在铝热剂上面加少量氯酸钾,并在混合物中间插一根镁条,点燃镁条,就能引发铝热反应 | |
| D. | Al(OH)3胶体的本质特征是能产生丁达尔效应 |
 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | b>f | |
| B. | 平衡常数K(1000℃)<K(810℃) | |
| C. | 915℃,2.0MPa该反应的平衡常数为Kp=4.5MPa | |
| D. | 1000℃,3.0MPa时E的转化率为83% |
发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}CrO_{7}}$CH3CH2CH2CHO反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95.C,在E中收集90.C以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77.C馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中?不能 (填“能”或“不能”)说明理由容易发生迸溅.
(2)加入沸石的作用是防止暴沸.
(3)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”
(5)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(6)本实验中,正丁醛的产率为51.4%.