题目内容
16.下列说法正确的是( )(1)增加水的量或升高温度,一定可以加快镁跟水的反应速率
(2)增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(3)对于反应CaCO3(s)?CaO(s)+CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对于反应3H2(g)+N2(g)?2NH3(g),在密闭容器中进行(固定体积),现充入氦气,由于容器中压强增大,则化学反应速率加快
(5)对于反应3H2(g)+N2(g)?2NH3(g),使用适合催化剂,正逆反应速率同等程度加快.
| A. | (1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | (5) |
分析 (1)镁跟水的反应速率和水量的多少没有关系;
(2)浓硫酸和金属锌之间反应生成的不是氢气;
(3)增加CaCO3的量,反应速率不变;
(4)充入氦气,不影响反应速率;
(5)催化剂同等程度改变反应速率.
解答 解:(1)镁跟水的反应速率和水量的多少没有关系,升高温度,可以加快镁跟水的反应速率,故错误;
(2)浓硫酸和金属锌之间反应生成的不是氢气而是二氧化硫,故错误;
(3)增加CaCO3的量,浓度不变,反应速率不变,故错误;
(4)充入氦气,由于参加反应气体的浓度不变,则不影响反应速率,故错误;
(5)催化剂可降低反应的活化能,同等程度改变反应速率,故正确.
故选D.
点评 本题多角度考查化学反应速率的影响,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
6.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1L 1mol•L-1的盐酸中,含HCl分子数为NA | |
| B. | 0.1mol Na2O2与水完全反应,转移0.2NA个电子 | |
| C. | 8.4gNaHCO3固体中含HCO3-数目为0.1NA | |
| D. | 将含Na+数目为NA的NaCl固体溶于1L水中,所得溶液的浓度为1mol•L-1 |
7.下列物质混合后,能发生离子反应的是( )
| A. | 硝酸钠溶液和氯化钡溶液 | B. | 硝酸钠溶液与氯化钾溶液 | ||
| C. | 稀盐酸和碳酸钠溶液 | D. | 稀硫酸滴到铜片上 |
1.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.8g水中所含有氧原子数目为0.1NA | |
| B. | 常温常压下,2.24LCO2气体中含氧原子数目为0.2NA | |
| C. | 0.1mol/LCuCl2溶液中,含有Cl-离子的数目为0.2NA | |
| D. | 常温常压下,23gNa+中含有的电子数为NA |
8.由铜、锌、CuSO4溶液,ZnSO4溶液组成如图所示的原电池,则下列说法正确是( )


| A. | a极为铜,b极为锌 | |
| B. | 当正极质量增加64g时,负极质量减小65g | |
| C. | A池中盛放的是CuSO4溶液,B池中盛放的是ZnSO4溶液 | |
| D. | 盐桥中的阳离子向锌极移动,阴离子向铜极移动 |
5.nL三种气态烃混合物与足量氧气混合点燃后,恢复到原来状态(常温常压),体积共缩小2nL,这三种烃不可能的组合是( )
| A. | CH4、C2H4、C3H4以任意比混合 | |
| B. | C2H6、C4H6、C2H2以2:1:2的物质的量之比混合 | |
| C. | C3H8、C4H8、C2H2以11:14:26的质量之比混合 | |
| D. | CH4、C3H6、C2H2以a:b:b体积比混合 |
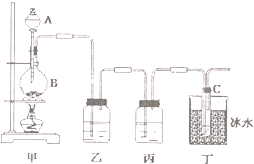 某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:
某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题: