题目内容
14.下列叙述正确的是( )| A. | NH4Cl是电解质,所以NH4Cl在溶液通电时可以电离 | |
| B. | Al(OH)3是两性氢氧化物,所以不能用过量的氨水与铝盐制备 | |
| C. | 在铝热剂上面加少量氯酸钾,并在混合物中间插一根镁条,点燃镁条,就能引发铝热反应 | |
| D. | Al(OH)3胶体的本质特征是能产生丁达尔效应 |
分析 A.氯化铵受热分解;
B.氢氧化铝只能溶于强碱;
C.铝热反应为放热反应,反应开始后不需要继续加热;
D.胶体的本质特征是分散质粒度介于1-100nm.
解答 解:A.NH4Cl是电解质,氯化铵受热分解,故A错误;
B.氢氧化铝只能溶于强碱,氨水为弱碱不能与氢氧化铝反应,所以可以用氯化铝与一水合氨反应制取氢氧化铝,故B错误;
C.铝热反应为放热反应,引发铝热反应的操作为:在铝热剂上面加少量氯酸钾,并在混合物中间插一根镁条,点燃镁条,就能引发铝热反应,故C正确;
D.胶体的本质特征是分散质粒度介于1-100nm,故D错误;
故选:C.
点评 本题考查了电解质性质、胶体的性质、铝热反应,侧重考查学生对基础知识掌握的熟练程度,题目难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
5.nL三种气态烃混合物与足量氧气混合点燃后,恢复到原来状态(常温常压),体积共缩小2nL,这三种烃不可能的组合是( )
| A. | CH4、C2H4、C3H4以任意比混合 | |
| B. | C2H6、C4H6、C2H2以2:1:2的物质的量之比混合 | |
| C. | C3H8、C4H8、C2H2以11:14:26的质量之比混合 | |
| D. | CH4、C3H6、C2H2以a:b:b体积比混合 |
9.用惰性电极实现如下电解过程,下列说法正确的是( )
| A. | 电解稀硫酸溶液实质上是电解水,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸钠溶液,在阴极上发生反应:4OH-4e-═2H2O+O2↑ | |
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
19.1986年,人们成功的用如下反应制得了氟气:①2KMnO4+2KF+10HF+3H2O2═2K2MnF6+8H2O+3O2↑②K2MnF6+2SbF5═2KSbF6+MnF4 ③2MnF4═2MnF3+F2↑.下列说法中正确的是( )
| A. | 反应①、②、③都是氧化还原反应 | |
| B. | 反应①中H2O2被还原 | |
| C. | 氧化性:KMnO4>O2 | |
| D. | 每生成1mol F2,上述反应共转移2mol电子 |
1.t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)?2Z(g),各组分在不同时刻的浓度如表:下列说法正确的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol•L-1 | 0.08 | a | b |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为20% | |
| B. | t℃时,该反应的平衡常数为40 | |
| C. | 前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol•L-1•min-1 | |
| D. | 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |
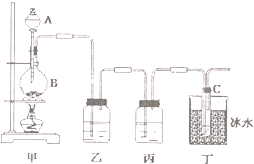 某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:
某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题: