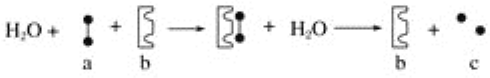题目内容
【题目】钒的化合物常用于制作催化剂和新型电池。回答下列问题:
(1)金属钒可由铝热反应制得。已知25℃、101 kPa时,
4A1(s)+3O2(g)=2Al2O3 (s) △H1=a kJ·mol-1
4V(s) +5O2 (g)=2V2O5(s) △H2=b kJ·mol-1
则用铝热反应冶炼金属V(s)的热化学方程式为_____________________。
⑵V2O5为橙黄至砖红色固体,无味、有毒,微溶于水,是许多有机和无机反应的催化剂。下图表示的是25℃时,部分含钒微粒的存在形式、浓度和存在的pH范围(其余可溶性微粒均未标出),图中“[V]”表示含钒微粒的浓度,虚线表示[V]或pH的范围尚未准确确定。
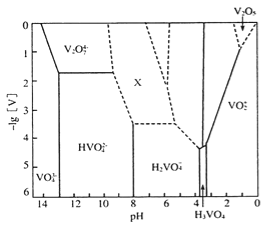
①V2O5溶于足量2mol L-1NaOH溶液中,发生反应的离子方程式为_________________,向反应后的溶液中,滴加硫酸溶液至过量(pH<1)的过程中,开始溶液保持澄淸,滴加一段时间后,观察到有橙黄色沉淀产生,继续滴加硫酸溶液,沉淀又消失。则沉淀消失过程中发生反应的化学方程式为_______________。
②上述滴加硫酸溶液的过程中,先后发生如下反应:

则“X所示区域溶液中的离子”不可能是___________(填序号);
a.V3O93- b.V4O103- c. V4O124-
(3)V2O5是反应2SO2+O2![]() 2SO3的催化剂。其他条件不变,加入V2O5后,该反应的速率加快的原因是_______________;恒温恒压下,加人V2O5,该反应的平衡常数________________ (填“增大”、 “减小”或“不变”);
2SO3的催化剂。其他条件不变,加入V2O5后,该反应的速率加快的原因是_______________;恒温恒压下,加人V2O5,该反应的平衡常数________________ (填“增大”、 “减小”或“不变”);
(4)下图所示为可充电的全钒液流电池构造示意图,该电池中的隔膜只允许H+通过。电池放电时,负极区溶液的pH将_____________(填“增大”、“减小”或“不变”),电池充电时,阳极的电极反应式为_____________________。

【答案】 10Al(s)+3V2O5(s)═5Al2O3(s)+6V(s) ΔH=(2.5a-l.5b)kJ·mol-1 V2O5+6OH-═2VO43-+3H2O V2O5+H2SO4═(VO2)2SO4+H2O b 加入V2O5后,反应路径发生改变,反应的活化能降低,反应速率加快 不变 增大 VO2+-e-+H2O═VO2++2H+
【解析】(1)金属钒可由铝热反应制得。已知25℃、101 kPa时,
①4A1(s)+3O2(g)=2Al2O3 (s) △H1=a kJ·mol-1
②4V(s) +5O2 (g)=2V2O5(s) △H2=b kJ·mol-1
根据盖斯定律,(①×5-②×3)/2,则用铝热反应冶炼金属V(s)的热化学方程式为10Al(s)+3V2O5(s)═5Al2O3(s)+6V(s) ΔH=(2.5a-l.5b)kJ·mol-1
⑵①由图可知,在碱性条件下,以VO43-形式存在,V2O5溶于足量2mol L-1NaOH溶液中,发生反应的离子方程式为V2O5+6OH-═2VO43-+3H2O;沉淀消失过程中发生反应的化学方程式为V2O5+H2SO4═(VO2)2SO4+H2O;②H2VO4―缩水后,V的化合价不变,所以不可能的是V4O102― ;(3)加入V2O5后,该反应的速率加快的原因是反应路径发生改变,反应的活化能降低,反应速率加快。反应温度不变,平衡常数不变;(4)原电池中H+ 带正电,移向正极,故负极区溶液的pH将增大;电池充电时,阳极发生氧化反应,电极反应式为VO2+-e-+H2O═VO2++2H+。