题目内容
【题目】已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值与温度高低有关。当n(NaOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n(NaOH)=a mol时,下列有关说法错误的是
A. 参加反应的氯气的物质的量等于a/2 mol
B. 改变温度,产物中NaClO3的最大理论产量为a/7 mol
C. 改变温度,反应中转移电子的物质的量ne的范围:a/2 mol≤ne≤5a/6 mol
D. 若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]()
【答案】B
【解析】
A、产物NaC1、NaClO、NaClO3中,Na元素与Cl元素的物质的量之比均为1:1,所以加反应的氯气的物质的量为NaOH物质的量的1/2;B、改变温度,产物为NaC1O3和氯化钠,无有NaClO;C、假设发生反应1:Cl2+2NaOH=NaCl+NaClO+H2O,求出反应中转移电子的物质的量n(e-),假设发生反应2:3Cl2+6NaOH=5NaCl+NaClO3+3H2O,求出反应中转移电子的物质的量n(e-),据以上分析电子转移的范围;D、若反应后c(Cl-)/c(ClO-)=11,令NaC1、NaClO分别为11 mol、1 mol,据得失电子守恒可得NaC1O3为2 mol,最后可以计算出c(ClO-)/c(ClO3-)比值。
本题主要是考查氧化还原反应的相关计算,涉及极限法、原子守恒法等。
A、根据原子守恒n(NaOH)=amol=n(Na) =n(Cl) =2n(Cl2),则n(Cl2) =1/2amol,A正确;B、改变温度,产物中NaC1O3的最大理论产量即无NaClO生成,发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O,则NaC1O3的物质的量为1/6amol,B错误;C、当全部生成NaC1、NaClO时发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O,则 n(e-)=1/2amol,同理,当全部生成NaC1、NaClO3时发生的反应为3Cl2+6NaOH=5NaCl+NaClO3+3H2O,则 n(e-)=5/6amol,综上可得改变温度,反应中转移电子的物质的量n(e-)的范围:1/2amol≤ne≤5/6amol,C正确;D、若反应后c(Cl-)/c(ClO-)=11,令NaC1、NaClO分别为11 mol、1 mol,据得失电子守恒可得NaC1O3为2 mol,则溶液中c(ClO-)/c(ClO3-)=1/2,D正确;正确选项B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表所列各组物质中,物质之间能通过一步反应实现如图所示转化的是
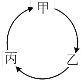
物质 选项 | 甲 | 乙 | 丙 |
A | SO2 | SO3 | H2SO4 |
B | NH4Cl | NH3 | NO |
C | Na2O | NaCl | NaOH |
D | Al(OH)3 | Al2O3 | AlCl3 |
A. A B. B C. C D. D
【题目】25℃时,物质的量浓度均为0.1molL﹣1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)①中由水电离出的c(OH-)________(填“>”“=”或“<”)②中由水电离出的c(H+)。
(2)③中共存在______种粒子,pH=8.4的原因:_______________________________;
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
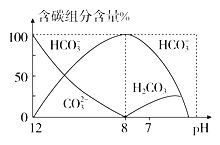
回答下列问题:
①当pH=7时,溶液中含碳元素的主要微粒为________
②已知在25 ℃时,CO![]() 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=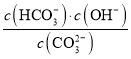 =2.0×10-4 mol·L-1,当溶液中c(HCO
=2.0×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=2∶1时,溶液的pH=______________。
)=2∶1时,溶液的pH=______________。