题目内容
【题目】下列反应属于氧化还原反应的是
A. H2O+SO3=H2SO4 B. CH4+2O2![]() CO2+2H2O
CO2+2H2O
C. 2Fe(OH)3![]() Fe2O3+3H2O↑ D. NaHCO3+NaOH=Na2CO3+H2O
Fe2O3+3H2O↑ D. NaHCO3+NaOH=Na2CO3+H2O
【答案】B
【解析】
氧化还原反应的特征是元素化合价的升降,如发生氧化还原反应,肯定存在元素化合价的变化,以此解答该题。
A.反应H2O+SO3=H2SO4为化合反应,各元素化合价都没有发生变化,不是氧化还原反应,故A不符合;
B.反应CH4+2O2![]() CO2+2H2O中C、O元素化合价发生变化,属于氧化还原反应,故B符合;
CO2+2H2O中C、O元素化合价发生变化,属于氧化还原反应,故B符合;
C.反应2Fe(OH)3![]() Fe2O3+3H2O为分解反应,各元素化合价都没有发生变化,不是氧化还原反应,故C不符合;
Fe2O3+3H2O为分解反应,各元素化合价都没有发生变化,不是氧化还原反应,故C不符合;
D.反应NaHCO3+NaOH=Na2CO3+H2O为复分解反应,各元素化合价都没有发生变化,不是氧化还原反应,故D不符合;
故答案选B。

【题目】25℃时,物质的量浓度均为0.1molL﹣1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)①中由水电离出的c(OH-)________(填“>”“=”或“<”)②中由水电离出的c(H+)。
(2)③中共存在______种粒子,pH=8.4的原因:_______________________________;
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
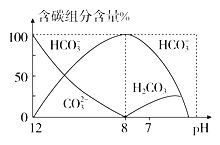
回答下列问题:
①当pH=7时,溶液中含碳元素的主要微粒为________
②已知在25 ℃时,CO![]() 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=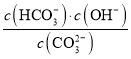 =2.0×10-4 mol·L-1,当溶液中c(HCO
=2.0×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=2∶1时,溶液的pH=______________。
)=2∶1时,溶液的pH=______________。