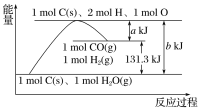
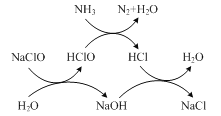
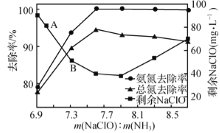
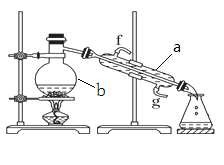
题目内容
【题目】为测定某碳酸钠样品的纯度,取一定质量碳酸钠样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体224mL(标准状况下)。计算:
(1)该碳酸钠样品中碳酸钠的物质的量是_____________。
(2)盐酸的物质的量浓度是____________。
【答案】0.01mol 0.5mol/L
【解析】
碳酸钠与盐酸反应的方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据反应关系Na2CO3---CO2![]() 2HCl,结合二氧化碳气体的物质的量进行相关计算。
2HCl,结合二氧化碳气体的物质的量进行相关计算。
(1) 碳酸钠与盐酸反应的方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据反应关系可知,Na2CO3![]() CO2,二氧化碳气体224mL,气体的物质的量为0.01mol,所以n(Na2CO3)=0.01mol;
CO2,二氧化碳气体224mL,气体的物质的量为0.01mol,所以n(Na2CO3)=0.01mol;
故答案是:0.01mol;
(2) 碳酸钠与盐酸反应的方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,盐酸与碳酸钠恰好完全反应,满足关系:2HCl![]() CO2,所以n(HCl)=0.02mol,c(HCl)=
CO2,所以n(HCl)=0.02mol,c(HCl)=![]() =0.5mol/L;
=0.5mol/L;
故答案是:0.5mol/L。

【题目】某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。
某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)
选项 | 预测物质的化学式 | 检验需要的试剂 | 操作、现象及结论 |
A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
B | Na2CO3 | 稀盐酸、澄清的石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
C | Na2SO3 | 稀盐酸、澄清的石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
A.AB.BC.CD.D